
| A. | 0.022mol•L-1 | B. | 0.045 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.1 mol•L-1 |
分析 设混合气体中含有xmolHCl,ymolN2,根据平均相对分子质量可计算气体的物质的量之比,进行喷泉实验时,氯化氢溶于水,得到的为盐酸溶液,HCl的体积等于溶液的体积,以此可计算溶液浓度.
解答 解:设混合气体中含有xmolHCl,ymolN2,则:$\frac{36.5x+28y}{x+y}$=34.8,解得x:y=4:1,
假设烧瓶体积为5V,则HCl为4V,N2的体积为V,
氯化氢溶于水,得到的为盐酸溶液,HCl的体积等于溶液的体积,
则溶质物质的量浓度为:$\frac{\frac{4V}{22.4L/mol}}{4V}$=0.045mol/L,
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用,关键是判断HCl的体积和溶液的体积相等.


科目:高中化学 来源: 题型:选择题
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 氢氧化钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
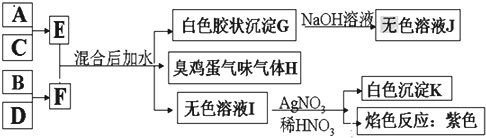
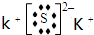 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 加入试剂 | 有关化学方程式 |
| FeCl2(FeCl3)(溶液) | Fe | 2FeCl3+Fe=3FeCl2 |
| MgO(Al2O3) | NaOH溶液 | Al2O3+2NaOH═2NaAlO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.
化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com