
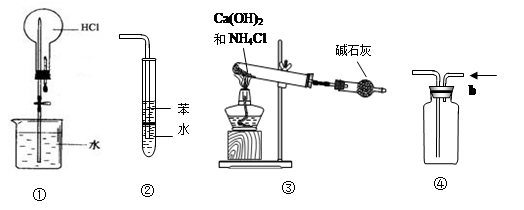
| A.装置①可用于做HCl喷泉实验 |
| B.装置②可用于吸收HCl气体,并防倒吸 |
| C.装置③可用于实验室制备少量NH3 |
| D.装置④b口进气可收集CO2等气体 |
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题
 |  |  | 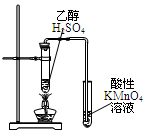 |
| A.测定生成CO2的化学反应速率 | B.制得Fe(OH)2并能保存较长时间不变质 | C.测量Cu与浓硝酸反应产生气体的体积 | D.证明CH3CH2OH发生消去反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
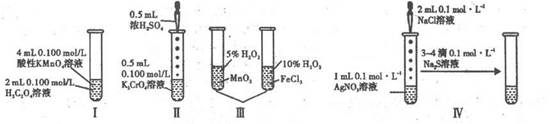
| A.实验I :反应开始时反应速率由慢变快,再变慢 |
| B.实验II :滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
| C.实验III:由该实验可以验证催化剂的催化效果 |
| D.实验IV:能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.盐酸 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.碳酸钠溶液,则加入试剂的顺序是(填编号)______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.利用图①装置做喷泉实验 |
| B.利用图②装置吸收尾气SO2 |
| C.利用图③装置进行胶体电泳实验可以说明Fe(OH)3胶体带正电荷 |
| D.利用图④装置用MnO2和浓盐酸制备并收集Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用量筒量取15.50mL 0.100 mol·L-1盐酸 |
| B.用无水酒精萃取碘水中的碘 |
| C.用过量浓氨水洗涤试管内的银镜 |
| D.做H2还原CuO实验时,要先通氢气,验纯后再加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 实验 编号 | A(KMnO4溶液浓度/mol·L-1) | B(草酸溶液浓度/mol·L-1) | C(硫酸溶液浓度/mol·L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
| | A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | ||||||
| 浓度/mol·L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
| c(H2SO4)/mol·L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用天平称量20.5g某物质。砝码和药品的位置放反,所得药品的质量 |
| B.测定Na2CO3溶液的pH时先将pH试纸润湿了再测定,所测得的pH值 |
| C.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度 |
| D.酸式滴定管在盛装标准溶液前没有用标准溶液润洗,测得的待测液浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH) 4-、Fe3+、HCO3- |
| B.某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 |
| C.固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 |
| D.加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com