

| A.利用图①装置做喷泉实验 |
| B.利用图②装置吸收尾气SO2 |
| C.利用图③装置进行胶体电泳实验可以说明Fe(OH)3胶体带正电荷 |
| D.利用图④装置用MnO2和浓盐酸制备并收集Cl2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题
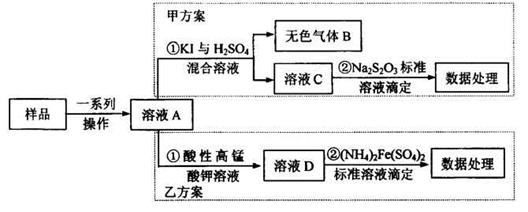
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
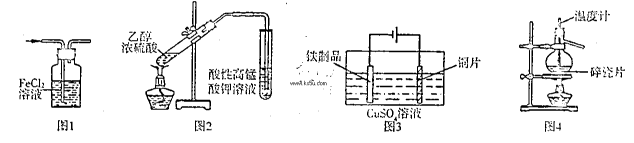
| A.用图1所示装置除去HCI气体中的少量C12 |
| B.用图2所示装置检验加热时产生的乙烯 |
| C.用图3所示装置在铁制品表面镀铜 |
| D.用图4所示装置分离溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.中和热测定实验中,若用铜质搅拌器,则所测中和热的绝对值偏大 |
| B.用待测液润洗滴定用的锥形瓶,会使滴定结果偏低 |
| C.滴定终点读取滴定管刻度时,俯视标准液液面,会导致测定结果偏大 |
| D.配制一定物质的量浓度的溶液,定容时仰视刻度线,会使所配溶液浓度偏低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
| A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |

 Na2S2O3
Na2S2O3
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
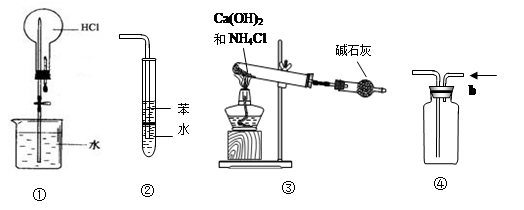
| A.装置①可用于做HCl喷泉实验 |
| B.装置②可用于吸收HCl气体,并防倒吸 |
| C.装置③可用于实验室制备少量NH3 |
| D.装置④b口进气可收集CO2等气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向苯中滴加溴水制备溴苯 |
| B.用碱式滴定管量取20.00mL KMnO4溶液 |
| C.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH) 3胶体 |
| D.向含有I-的溶液中滴加氯水和CCl4,振荡、静置检验I-的存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将碘水倒入分液漏斗,再加适量苯,充分振荡、静置、过滤,可从碘水中获取碘 |
| B.从CuSO4溶液得到CuSO4·5H2O的操作是加热浓缩,冷却结晶 、过滤、洗涤、干燥 |
| C.室温下向滴有酚酞的NaOH溶液中滴加稀盐酸当红色恰好退去时所得溶液pH=7 |
| D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
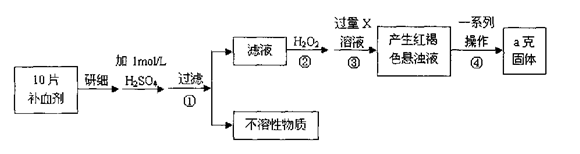 请回答下列问题:
请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com