
【题目】下列叙述正确的是
A. 非金属元素形成的离子一定是阴离子
B. 非金属单质在氧化还原反应中一定是氧化剂
C. 某元素从化合态变为游离态时,一定被还原
D. 金属阳离子被还原不一定得到金属单质
科目:高中化学 来源: 题型:
【题目】2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
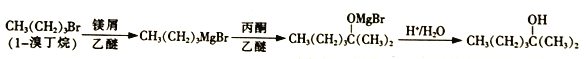
已知:RMgBr化学性质活泼,易与H2O、R'X等发生反应生成RH、R-R'。
(1)仪器A的名称是___________。
(2)引发CH3(CH2)3Br与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是_____,若镁屑不足,则反应时生成的有机副产物为________(填结构简式)。

(3)干燥管中无水氯化钙的作用为__________。
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为_________。
(5)起始加入三颈烧瓶的1-溴丁烷的体积为5mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有重要作用。
( I )下列关于实验的叙述中正确的有______________(填字母)。
A.酒精灯使用结束后,应立即吹灭
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
D.取用Na2SO4溶液时,发现取量过多,为了不浪费,应把多余的试剂倒入原试剂瓶中
E.称量氢氧化钠固体时,应先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称
F.使用分液漏斗前要检查其是否漏水
G.测量溶液pH时,应先将pH试纸润湿
( II )化学家研究物质的组成和性质时,首先需要将被研究的物质从混合物中分离出来并加以提纯,以下是常见的可用于分离或提纯物质的部分仪器和方法:
仪器:

方法:① 过滤;② 结晶;③ 蒸馏;④ 萃取分液。
请将相应的字母填入空白处:
实验 | 所需仪器 | 方法 |
除去水中混有的泥沙 | _______ | _______ |
从海水中获取淡水 | _______ | _______ |
分离碘和水的混合物 | _______ | _______ |
从海水中获取粗盐 | _______ | _______ |
( III ) 实验室用63%的浓HNO3 (其密度为1.4 g·mL-1)配制480 mL 0.25 mol·L-1稀HNO3;可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.托盘天平 f.10 mL量筒 g.50 mL量筒
回答下列问题:
(1)此浓硝酸的物质的量浓度为________mol·L-1。
(2)量取63%的浓硝酸时应选用________(填仪器的字母编号)量取________mL。
(3)实验时,上述仪器中还需要选用的有_________(填字母),还缺少的仪器有_______、_____ (写仪器名称)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏低的是________________ (填序号)。
①用量筒量取浓硝酸时,眼睛俯视刻度线
②容量瓶使用时底部残留有水
③定容时眼睛俯视刻度线
④移液时不小心有少量液体洒到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“冰→液体水→氢气和氧气”的变化过程中,微粒间被破坏的作用力依次是( )
A.范德华力、范德华力
B.范德华力、共价键
C.共价键、范德华力
D.共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp[Mg(OH)2]=10-12,Ksp(MgF2)=10-10。下列说法正确的是( )
A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
B. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
C. 25℃时,Mg(OH)2固体在20mL 0.01 molL-1氨水中的Ksp比在20mL 0.01 molL-1NH4Cl溶液中的Ksp小
D. 25℃时,欲用1L NaF溶液将0.05mol Mg(OH)2完全转化为MgF2,则c(NaF)≥1.1 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
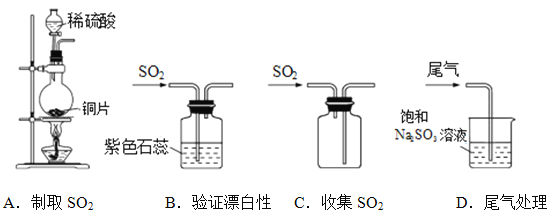
【题目】葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
I.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是____________
(2)设计实验验证SO2与Fe2+ 还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_________溶液,观察到_____________, 可知混合液中无Fe3+;
向乙中滴加_________溶液,观察到______________,可知混合液中有__________由此得出结论:SO2的还原性强于Fe2+ 。
II.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或HSO3-。设计如图1的实验:
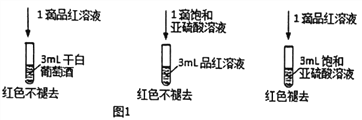
甲同学得出实验结论:干白葡萄酒中不含SO2或HSO3-。这个结论是否合理_____(填“是”或“否”)说明理由__________________________________________。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
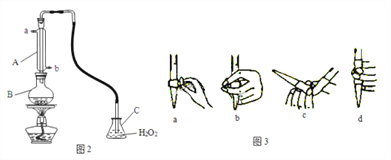
实验步骤:
i. 检查装置的气密性后,向图2仪器B中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与C中H2O2完全反应
iii. 除去C中过量的H2O2
iv. 用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①仪器A的名称是____,A的进水口为____,滴定前排气泡时,应选择图3中的___。
②C中反应生成物的化学式是________,除去过量H2O2的方法是_________________。
③滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为____g/L,是否符合国家标准________(填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是______________。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双一(对烷氧基苯甲酸)-2,3一二氯—1,4—苯二酚酯(G)是一种新的液晶化合物,在液晶显示领域里有广泛的应用,其合成路线如下:

已知:R为烷烃基,D的核磁共振氢谱为四组峰,且峰面积之比为9:2:2:1。
回答下列问题:
(1)A的结构简式为______________________________。
(2)B的化学名称为_________________________。
(3)A与B生成C的化学方程式为_____________________________。
(4)由E生成G的反应类型为______________________。
(5)G的分子式为______________________。
(6)H是D的同分异构体,H的苯环上只有两个对位的取代基,H可与FeCl3溶液发生显色反应,且能发生水解反应和银镜反应,则H共有______种;其中核磁共振氢谱为六组峰,且峰面积之比为1:2:6:2:2:1的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)硫酸铜溶液呈蓝色,是因为其中含有[Cu(H2O)4]2+,该离子的结构简式为______(标出配位键,不考虑空间构型)。向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水至沉淀刚全部溶解时可得到蓝色的[Cu(NH3)4SO4溶液,继续向其中加入乙醇会有蓝色晶体析出,原因是_______。
(2)新制Cu(OH)2悬浊液可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙酸的沸点高于乙醛的主要原因是____________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。该配合物中与中心Cu形成配位健的原子_________。BF4-的空间构型为_____,与其互为等电子体的分子是_____________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A。其结构如图所示。

①1mol氨基乙酸钠(H2NCH2COONa)含有σ键的数目为_______。
②标出配合物A中的配位键________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com