
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)硫酸铜溶液呈蓝色,是因为其中含有[Cu(H2O)4]2+,该离子的结构简式为______(标出配位键,不考虑空间构型)。向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水至沉淀刚全部溶解时可得到蓝色的[Cu(NH3)4SO4溶液,继续向其中加入乙醇会有蓝色晶体析出,原因是_______。
(2)新制Cu(OH)2悬浊液可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙酸的沸点高于乙醛的主要原因是____________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。该配合物中与中心Cu形成配位健的原子_________。BF4-的空间构型为_____,与其互为等电子体的分子是_____________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A。其结构如图所示。

①1mol氨基乙酸钠(H2NCH2COONa)含有σ键的数目为_______。
②标出配合物A中的配位键________。
【答案】  乙醇降低了[Cu(NH3)4]SO4在水中的溶解度 乙酸能形成分子间氢键,而乙醛不能 N 正四面体型 CCl4 8NA
乙醇降低了[Cu(NH3)4]SO4在水中的溶解度 乙酸能形成分子间氢键,而乙醛不能 N 正四面体型 CCl4 8NA 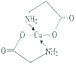 或
或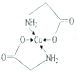
【解析】(1)考查配位键,Cu2+提供空轨道,H2O中O提供孤电子对,因此该离子的结构简式为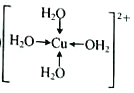 ;乙醇降低了[Cu(NH3)4]SO4在水中的溶解度;(2)考查氢键的形成条件,乙酸符合形成分子间氢键的条件,而乙醛不符合,因此乙酸能形成分子间氢键,而乙醛不能,因此乙酸的沸点比乙醛高;(3)考查配位键、空间构型、等电子体的判断,CH3CN中只有N有孤电子对,因此提供孤电子对的是N,即N与Cu形成配位键;BF4-中B含有4个σ键,孤电子对(3+1-4×1)/2=0,价层电子对数为4,空间构型为正四面体;与其互为等电子体的分子式为CCl4等;(4)考查化学键数目的判断。配位键的表示,①此化合物为离子化合物,是由H2NCH2COO-和Na+组成,1molH2NCH2COO-中含有σ键的数目是8NA;②Cu提供空轨道,O最外层6个电子,形成2个化学键,N最外层5个电子,形成三个共价键,达到稳定结构,根据化合物A的结构图,Cu和N形成配位键,即
;乙醇降低了[Cu(NH3)4]SO4在水中的溶解度;(2)考查氢键的形成条件,乙酸符合形成分子间氢键的条件,而乙醛不符合,因此乙酸能形成分子间氢键,而乙醛不能,因此乙酸的沸点比乙醛高;(3)考查配位键、空间构型、等电子体的判断,CH3CN中只有N有孤电子对,因此提供孤电子对的是N,即N与Cu形成配位键;BF4-中B含有4个σ键,孤电子对(3+1-4×1)/2=0,价层电子对数为4,空间构型为正四面体;与其互为等电子体的分子式为CCl4等;(4)考查化学键数目的判断。配位键的表示,①此化合物为离子化合物,是由H2NCH2COO-和Na+组成,1molH2NCH2COO-中含有σ键的数目是8NA;②Cu提供空轨道,O最外层6个电子,形成2个化学键,N最外层5个电子,形成三个共价键,达到稳定结构,根据化合物A的结构图,Cu和N形成配位键,即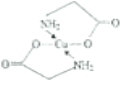 ,Cu配位数为4,因此还可以是
,Cu配位数为4,因此还可以是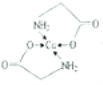 。
。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 非金属元素形成的离子一定是阴离子
B. 非金属单质在氧化还原反应中一定是氧化剂
C. 某元素从化合态变为游离态时,一定被还原
D. 金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.5mol/L的硫酸溶液480mL,根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 ___________________________。
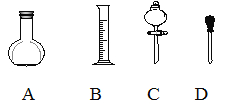
(2)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__mL,如果实验室有15mL、20mL、50mL量筒,应选用______ mL量筒最好。
(3)在容量瓶的使用方法中,下列操作不正确的是____________。
A、使用容量瓶前检验是否漏水
B、容量瓶用水洗净后,再用待配溶液洗涤
C、配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1—2cm处,用胶头滴管加蒸馏水至刻度线。
D、配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.5mol/L(填“大于”“小于”或“等于”)。
(5)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(l)Y在元素周期表中的位置是__________;X氢化物的电子式是__________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是__________。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。
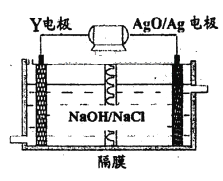
该电池的负极反应式是__________。
(4)Z和W比较,非金属性较弱的是__________(填元素符号),下列可以验证这一结论的是__________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1molH-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质,D为正盐。

请回答下列问题:
(1)写出各物质的名称:
A_____________ ; C_____________;D_____________。
(2)写出相应的离子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任写一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
A. 加热 B. 将锌片改成锌粉
C. 滴加少量CuSO4溶液 D. 加入适量Na2CO3粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期的元素A、Z、Q、R、T的原子序数依次增大,且A、Z、Q同周期。A共有两个原子轨道上有电子,且电子数目相同。Z、Q相邻,且Z中的未成对电子数为3个,R元素在地壳中含量位于金属元素的第二位。T是人类最早使用的元素,并以这种元素命名了我国的一个时代。请回答下面的问题:
(1)A、Z、Q第一电离能从小到大的顺序为:_______________(填元素符号),T的价层电子排布图为:__________________________。
(2)Q的基态原子中能量最高的电子,其电子云在空间有___________个方向,原子轨道呈_______形。
(3)Z3-的立体构型为____________,写出与Z3-互为等电子体的一种非极性分子化学式____________。
(4)在不同的温度下,A以ACl2和二聚体A2Cl4两种形式存在,二聚体的结构式如图所示:
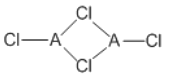
①ACl2中A的杂化方式为______________________。
②1mol A2Cl4中含配位键的数目为____________。
(5)R单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞的棱边长分别为acm、bcm,则R单质的体心立方晶胞和面心立方晶胞的密度之比为_________,R原子配位数之比为_____________。
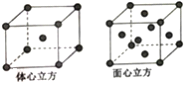
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法正确的是
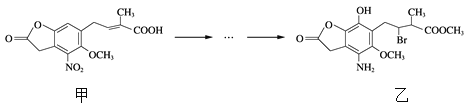
A. 甲的分子式为C14H14NO7
B. 甲、乙中各有1个手性碳原子
C. 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙
D. 乙能与盐酸、NaOH溶液反应,且1 mol乙最多能与5 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )
A.A电极上发生的电极反应是还原反应
B.A的金属性强于B
C.电子不断由A电极经外电路流向B电极
D.溶液中的阳离子移向负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com