
【题目】
A. C、C B. C、O C. C、N D. O、C
科目:高中化学 来源: 题型:
【题目】下列有关CuSO4溶液的叙述中正确的是
A. 该溶液呈电中性
B. 它与H2S反应的离子方程式为:Cu2++S2-=CuS↓
C. 用惰性电极电解该溶液时,阳极产生铜单质
D. 在溶液中:c (Cu2+) +c (H+)=c(SO42-) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
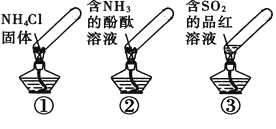
A. 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B. 加热时,②溶液褪色或红色变浅,冷却后又都变为红色
C. 加热时,③溶液褪色或红色变浅,冷却后又都变为红色
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI;3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 = 2KSCN + CO2 ↑ + H2O;
KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO![]() 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 ![]() NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是 ( )
A.酸性(水溶液):HSCN > H2CO3 > HCN
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. C60与碳纳米管互为同素异形体
B. 最简式为CH3的有机物没有同分异构体
C. CH3C(CH3)2CH2CH3名称为2,2-二甲基丁烷
D. 核外电子总数和质子数均相同的微粒必为同种粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1。下列有关元素X的说法错误的是( )
A. 元素X不可能是金属元素
B. 元素X的气态氢化物不一定是电解质
C. 元素X一定能形成化学式为KXO3的含氧酸钾盐
D. 工业上制取X的单质时一定采用氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)写出图中仪器a的名称:_______________。
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为_____________,发生和收集装置为____________(填字母)。
(3)实验室用石灰石和稀盐酸反应智取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的______________端口(填“①”或“②”)通入,F中发生的化学反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2(g)+O2(g)![]() 2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是

A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:a1>a2=a3D.容器中S03的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO![]() 、NO
、NO![]()
B.无色溶液中可能大量存在Al3+、NH![]() 、Cl-、S2-
、Cl-、S2-
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO![]()
D.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com