
【题目】A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图1所示(图中产物略去) 
(1)若A是能使湿润的红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种无色、无味的有毒气体.写出反应Ⅱ的化学方程式 .
(2)若A是淡黄色固体化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子的粒子.①C中所含化学键的类型是 , ②写出反应Ⅲ的离子方程式: .
(3)将一定量(2)中的气体D通入2L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图2(忽略气体的溶解和HCl的挥发). 
①O点溶液中所含溶质的化学式为;a点溶液中各离子浓度由大到小的关系是 .
②标况下,通入气体D的体积为L,C溶液的物质的量浓度为mol/L.
【答案】
(1)2NO+2CO ![]() N2+2CO2
N2+2CO2
(2)离子键和共价键;2OH﹣+CO2═CO32﹣+H2O
(3)NaOH、Na2CO3;c(Na+)>c(Cl﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣);44.8;2.5
【解析】解:(1)若A是能使湿润的红色石蕊试纸变蓝的气体,则A为NH3 , C、D均为空气的主要成分,且A与D能反应生成B,则D为O2 , 所以C为N2 , B为NO,E是一种有毒气体,且B与E反应生成C,则E为CO,反应Ⅱ的化学方程式为2NO+2CO ![]() N2+2CO2 , 所以答案是:2NO+2CO
N2+2CO2 , 所以答案是:2NO+2CO ![]() N2+2CO2;2)若A是淡黄色固体化合物,应是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),C是氢氧化钠,C中所含化学键的类型是离子键和共价键,反应Ⅲ的离子方程式为2OH﹣+CO2═CO32﹣+H2O,所以答案是:离子键和共价键;2OH﹣+CO2═CO32﹣+H2O;(3)①据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上Na2CO3需要的HCl大于NaHCO3 , 所以溶液中还存在NaOH;a点时溶液中的溶质是NaHCO3和NaCl,氯化钠为强碱强酸盐,钠离子和氯离子不水解,NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH﹣)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32﹣),根据元素守恒知c(Na+)>c(Cl﹣),根据图象知,NaOH需要HCl和碳酸钠需要HCl的物质的量之比为1:2,根据原子守恒知,生成氯化钠的物质的量和碳酸氢钠的物质的量之比为3:2,根据元素守恒知,溶液中离子浓度大小顺序是c(Na+)>c(Cl﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),所以答案是:NaOH、Na2CO3;c(Na+)>c(Cl﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣); ②由图象可知,加入HCl3mol时溶质是NaHCO3和NaCl,再加入2molHCl完全反应,则可知n(CO2)=n(NaHCO3)=n(HCl)=2mol,体积为2mol×22.4L/mol=44.8L, 加入盐酸5mol时完全反应,溶液溶质为NaCl,则n(NaOH)=n(HCl)=5mol,c(NaOH)=
N2+2CO2;2)若A是淡黄色固体化合物,应是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),C是氢氧化钠,C中所含化学键的类型是离子键和共价键,反应Ⅲ的离子方程式为2OH﹣+CO2═CO32﹣+H2O,所以答案是:离子键和共价键;2OH﹣+CO2═CO32﹣+H2O;(3)①据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上Na2CO3需要的HCl大于NaHCO3 , 所以溶液中还存在NaOH;a点时溶液中的溶质是NaHCO3和NaCl,氯化钠为强碱强酸盐,钠离子和氯离子不水解,NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH﹣)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32﹣),根据元素守恒知c(Na+)>c(Cl﹣),根据图象知,NaOH需要HCl和碳酸钠需要HCl的物质的量之比为1:2,根据原子守恒知,生成氯化钠的物质的量和碳酸氢钠的物质的量之比为3:2,根据元素守恒知,溶液中离子浓度大小顺序是c(Na+)>c(Cl﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),所以答案是:NaOH、Na2CO3;c(Na+)>c(Cl﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣); ②由图象可知,加入HCl3mol时溶质是NaHCO3和NaCl,再加入2molHCl完全反应,则可知n(CO2)=n(NaHCO3)=n(HCl)=2mol,体积为2mol×22.4L/mol=44.8L, 加入盐酸5mol时完全反应,溶液溶质为NaCl,则n(NaOH)=n(HCl)=5mol,c(NaOH)= ![]() =2.5mol/L,所以答案是:44.8;2.5.
=2.5mol/L,所以答案是:44.8;2.5.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列物质属于电解质的是①H2SO4 ②蔗糖 ③Na2CO3 ④Fe ⑤CO2 ⑥烧碱溶液
A. ①③⑤⑥ B. ①②③⑥ C. ①③⑥ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中加入2molN2和6molH2 , 发生如下反应N2(g)+3H2(g)=2NH3(g)△H<0,5min后平衡测得c(NH)3=0.5mol/L
(1)该条件下此反应的化学平衡常数的表达式K= . 温度升高,则K值 . (填“变大”、“变小”或“不变”)
(2)若平衡时,移走1molN2和3molH2 , 在相同温度下再达平衡时c(NH3)0.25mol/L.(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“氧化物—酸—碱—盐”顺序排列的是
A.CO HNO3 NaOH KNO3 B.CO2 H2CO3 Na2CO3 Ca(HCO3)2
C.H2SO4 HCl Mg(OH)2 MgCl2 D.SO3 NaHCO3 NaOH Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值,下列说法正确的是( )
A.1L 1 molL﹣1的Na2CO3 溶液中含有的阴离子数目大于NA
B.标准状况下,2.24LCCl4中含有共价键总数为0.4NA
C.常温常压下,18g D2O的原子总数为3NA
D.7.1g Cl2与足量的Fe反应,转移电子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究铁及其化合物对于工业生产具有重要意义.
(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是(用离子方程式表示).
(2)高铁酸钾(K2FeO4)是一种新型的水处理剂.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如图1所示: 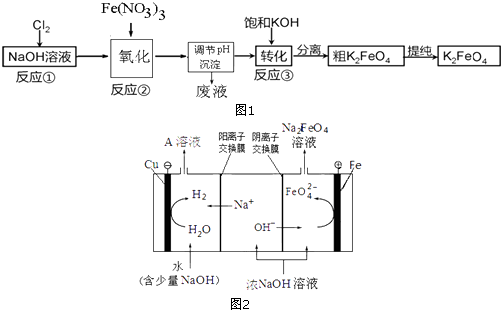
①反应②氧化过程所发生反应的离子方程式是: , 在生产中一般控制反应温度30℃以下,其原因是: .
②反应③中加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明 .
③在提纯K2FeO4中采用重结晶、过滤、洗涤、低温烘干的方法,洗涤滤渣的方法是 .
④若某温度下,将Cl2通入NaOH溶液中得到NaCl、NaClO、NaClO3的混合溶液,经测定溶液中ClO﹣与ClO3﹣的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 .
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4 , 其工作原理如图2所示:阳极的电极反应式为;其中可循环使用的物质是 . (填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是____________(填序号)。
a.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
b.高温使水分解制氢:2H2O(g)![]() 2H2+O2
2H2+O2
c.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
d.天然气制氢:CH4+H2O(g)![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
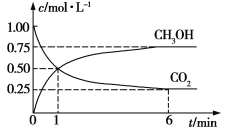
①从1 min到6 min,v(H2)=__________mol·L1·min1。
②能说明上述反应达到平衡状态的是_______(填编号)。
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3 mol H2,同时生成1 mol H2O
e.反应中CO2与H2的物质的量之比为1∶3且保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com