
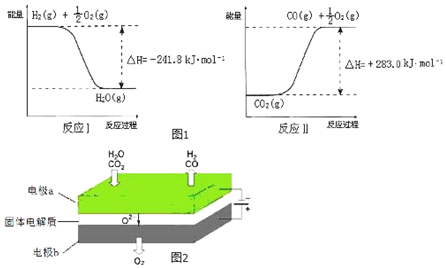
分析 (1)二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2与氧化性无关;
(2)根据图示反应Ⅰ和反应Ⅱ书写热化学反应方程式,构造目标方程式利用盖斯定律解答;
(3)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;电极b氧离子失去电子发生氧化反应生成氧气.
解答 解:(1)a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;
b.Li2O、Na2O、MgO均能吸收CO2,钠、镁为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;
c.Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;
故答案为:ab;
(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4$\stackrel{500℃}{→}$Li2CO3+Li2SiO3,
故答案为:CO2+Li4SiO4$\stackrel{500℃}{→}$Li2CO3+Li2SiO3;
(3)①CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气;
故答案为:氧化;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为CO2+2e-═CO+O2-,
故答案为:CO2+2e-═CO+O2-.
点评 本题主要考查了综合利用CO2,涉及热化学反应、电化学、化学平衡影响因素等,较为综合,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 35Cl-和37Cl-离子结构示意图均可以表示为: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: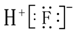 | |
| D. | 质子数为92、中子数为146的U原子:14692U |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤电厂的废气随意排放 | |
| B. | 采暖燃煤锅炉安装脱硝等净化设施 | |
| C. | 尽量步行或骑自行车出行 | |
| D. | 重污染工业企业持续推进能源结构调整 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有元素都有同位素 | |
| B. | 有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| C. | 一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 | |
| D. | 氧化物只可能是氧化产物,不可能是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的电子数为9NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 46 g NO2和N2O4的混合物含有的氮原子数为1NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com