
| A. | 所有元素都有同位素 | |
| B. | 有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| C. | 一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 | |
| D. | 氧化物只可能是氧化产物,不可能是还原产物 |
分析 A.不是所有元素都有同位素存在;
B.3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2不属于四种基本反应类型;
C.一种元素在同一物质中可显示不同价态,如Fe3O4、NH4NO3等;
D.CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO中,CO既是氧化产物也是还原产物.
解答 解:A.不是所有元素都有同位素存在,自然界中有20左右种元素未发现稳定的同位素同位素,故A错误;
B.3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2不属于四种基本反应类型,属于无机物之间的反应,则有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应,故B正确;
C.一种元素在同一物质中可显示不同价态,如Fe3O4、NH4NO3等,如在NH4NO3中N元素的化合价分别为+5、-3,二者不相邻,故C错误;
D.CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO中,CO既是氧化产物也是还原产物,则利用有单质参加的化合反应生成的氧化物既是氧化产物也是还原产物,故D错误;
故选B.
点评 本题考查氧化还原反应及四种基本反应类型等,综合性较强,把握常见的氧化还原反应实例及基本概念为解答的关键,注意利用实例分析解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 残余固体可能为铁和铜的混合物 | |
| B. | 最后得到的溶液可能含有Fe3+ | |
| C. | 残余固体是铁,溶液中一定不含Cu2+ | |
| D. | 残余固体一定全部是铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合:$\frac{3}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
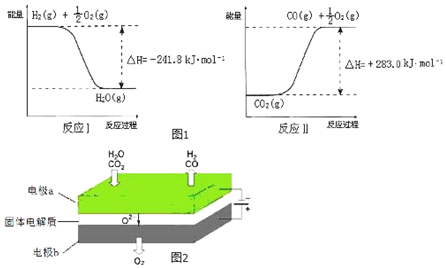
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | CCl4分子的比例模型为  其空间构型为正四面体 其空间构型为正四面体 | |
| C. | 全降解塑料  可由环氧丙烷 可由环氧丙烷  和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com