
����Ŀ���Ͽ�1 mol AB(g)�����еĻ�ѧ��ʹ��ֱ�������̬Aԭ�Ӻ���̬Bԭ�������յ�������ΪA��B���ļ��ܡ��±��г���һЩ��ѧ���ļ���E��
��ѧ�� | H��H | Cl��Cl | O===O | C��Cl | C��H | O��H | H��Cl |
E/kJ��mol��1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
��ش��������⣺
��ͼ��ʾij��Ӧ�������仯��ϵ����˷�ӦΪ________(����ȡ����ȡ�)��Ӧ�����Ц�H��______________(�ú���a��b�Ĺ�ϵʽ��ʾ)��
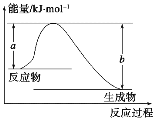
��ͼʾ�б�ʾ��Ӧ H2(g)��O2(g)===H2O(g) ��H����241.8 kJ��mol��1����b��________kJ��mol��1��x��__________��
(3)��ʷ�����á��ؿ���������������һ��������CuCl2����������450 �����ÿ����е��������Ȼ��ⷴӦ����������Ӧ�Ļ�ѧ����ʽΪ___________________________________���������¶Ⱥ�ѹǿ�Է�Ӧ�ȵ�Ӱ�죬���������е��й����ݣ����㵱��Ӧ����1 mol����ת��ʱ����Ӧ�������仯Ϊ______________��
���𰸡����� (a��b)kJ��mol��1 926 496.4 O2��4HCl![]() 2Cl2��2H2O �ų�����31.4 kJ
2Cl2��2H2O �ų�����31.4 kJ
��������
��1����ͼ��֪��Ӧ�������������������������������ڷ��ȷ�Ӧ���ʱ���ڶϿ���Ӧ���л�ѧ�����յ�������ȥ�γ��������л�ѧ���ͷŵ�������
��2��bΪ1molˮ�к��еĻ�ѧ���ļ��ܣ���Ϊ2����O��H�ļ��ܣ������ʱ��H=��Ӧ��ļ����ܺͣ�������ļ����ܺͿɼ����x��ֵ��
��3����CuCl2����������450�����ÿ����е��������Ȼ��ⷴӦ������������������ˮ���ȸ��ݡ�H=��Ӧ��ļ����ܺͣ�������ļ����ܺ������Ӧ�ġ�H��Ȼ�����ת�Ƶ��������ʱ�Ķ�Ӧ������ϵȷ�������仯��
��1����ͼ��֪��Ӧ�������������������������������ڷ��ȷ�Ӧ���ʱ���ڶϿ���Ӧ���л�ѧ�����յ�������ȥ�γ��������л�ѧ���ͷŵ���������ˡ�H=��a��b��kJmol-1��
��2��bΪ1molˮ�к��еĻ�ѧ���ļ��ܣ���Ϊ2����O��H�ļ��ܣ����b=2��463kJ/mol=926kJ/mol�������ʱ��H=��Ӧ��ļ����ܺ�-������ļ����ܺͿɵã�436+x/2-463��2=-241.8�����x=496.4��
��3����CuCl2����������450�����ÿ����е��������Ȼ��ⷴӦ������������������ˮ����Ӧ�Ļ�ѧ����ʽΪO2��4HCl![]() 2Cl2��2H2O���÷�Ӧ�ķ�Ӧ�ȡ�H=E��O=O��+4E��H-Cl��-2E��Cl-Cl��-4E��O-H��=��496.4+4��431-2��247-4��463��kJmol-1=��125.6 kJmol-1����1mol������ȫ��Ӧʱת��Ϊ4mol���ų�125.6kJ��������˵�1mol����ת��ʱ�ų�������Ϊ125.6kJ��1/4=31.4kJ��
2Cl2��2H2O���÷�Ӧ�ķ�Ӧ�ȡ�H=E��O=O��+4E��H-Cl��-2E��Cl-Cl��-4E��O-H��=��496.4+4��431-2��247-4��463��kJmol-1=��125.6 kJmol-1����1mol������ȫ��Ӧʱת��Ϊ4mol���ų�125.6kJ��������˵�1mol����ת��ʱ�ų�������Ϊ125.6kJ��1/4=31.4kJ��


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ʳ�β�����������λ������ʵ�����еIJ�����������ˮɹ����ԭ�����ǣ� ��
A.����B.����C.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״̬�£���̬���ӶϿ�1 mol��ѧ�����ʱ��Ϊ���ʡ���֪H��H��H��O��O===O���ļ�����H�ֱ�Ϊ436 kJ��mol��1��463 kJ��mol��1��495 kJ��mol��1�������Ȼ�ѧ����ʽ��ȷ����
A. H2O(g)===H2��1/2O2(g)��H����485 kJ��mol��1
B. H2O(g)===H2(g)��1/2O2(g) ��H����485 kJ��mol��1
C. 2H2(g)��O2(g)===2H2O(g) ��H����485 kJ��mol��1
D. 2H2(g)��O2(g)===2H2O(g) ��H����485 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L��0.01molNaAlO2��0.02molNaOH����Һ�л���ͨ�������̼����n(CO2)�����Ⱥ���������ͬ�ķ�Ӧ����0.01mol<n(CO2) ![]() 0.015ʱ�����ķ�Ӧ�ǣ�2 NaAlO2+ CO2+2H2O=2Al(OH)3��+Na2CO3���ж�Ӧ��ϵ��ȷ����( )
0.015ʱ�����ķ�Ӧ�ǣ�2 NaAlO2+ CO2+2H2O=2Al(OH)3��+Na2CO3���ж�Ӧ��ϵ��ȷ����( )
ѡ�� | n(CO2)/mol | ��Һ�����ӵ����ʵ���Ũ�� |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����NO�����ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�
2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�

A. �¶�T�£��÷�Ӧ��ƽ�ⳣ��K=![]()
B. �¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C. ����b��Ӧ�������ı�����Ǽ����˴���
D. ������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�Ͻ�㷺���ں��չ�ҵ�����и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�
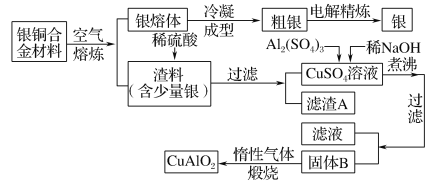
[ע��Al(OH)3��Cu(OH)2��ʼ�ֽ���¶ȷֱ�Ϊ450 ����80 ��]
��1����⾫����ʱ��������ӦʽΪ___________________________��
����A��ϡ���ᷴӦ�������������ڿ�����Ѹ�ٱ�Ϊ����ɫ���������ɫ�Ļ�ѧ��Ӧ����ʽΪ________________________��
��2����������B�����Ϊ________��
��3��������չ�����һ����Ӧ�Ļ�ѧ����ʽ��__
________CuO��________Al2O3![]() ________CuAlO2��________��
________CuAlO2��________��
��4��CuSO4��ҺҲ�������Ʊ������������������____________�����ˡ�ϴ�Ӻ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��F��G��ԭ������������������ֶ�����Ԫ�ء�A��B���γ�B2A��B2A2���ֻ����B��D��G�����������Ӧˮ��������֮�䶼�ܷ�Ӧ��D��F��Gԭ������������֮�͵���15���ش��������⣺
(1)EԪ����Ԫ�����ڱ��е�λ����__________��A���ӵĽṹʾ��ͼΪ____________��
(2)D�ĵ�����B������������Ӧˮ�������Һ��Ӧ�������ӷ���ʽΪ__________��
(3)��B2A2�к���___________����_________���������ʽΪ__________��
�ڸ�������ˮ��Ӧ�Ļ�ѧ����ʽΪ_______________��
(4)����˵����ȷ����__________(����ĸ���)��
��B��D��Eԭ�Ӱ뾶���μ�С
������Ԫ�ص���������ϼ۾�������ԭ�ӵ�����������
��D������������Ӧˮ����������ڰ�ˮ
��Ԫ����̬�⻯����ȶ��ԣ�F>A>G
(5)��E��F��G������������Ӧˮ�����У�������ǿ��Ϊ_________(�ѧʽ)����ԭ�ӽṹ����ԭ��ͬ����Ԫ�ص��Ӳ�����ͬ���������ң�_________���õ�����������ǿ��Ԫ�طǽ���������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ư�۾�Ư��ʱ�������Ư�۾�Ư������������Ч�����ǣ� ��
A.ʳ��B.CO2 ��ˮ����C.NaHSO4 ����D.ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����N2��H2�������ij�ܱ������У���һ�������·�����Ӧ���ﵽƽ�⣺N2(g)��3H2(g) ![]() 2NH3(g)����H��0�����ı�ij��������ά��������ֱ���µ�ƽ��ʱ���±��й�����ƽ����ԭƽ��ıȽ���ȷ����(����)
2NH3(g)����H��0�����ı�ij��������ά��������ֱ���µ�ƽ��ʱ���±��й�����ƽ����ԭƽ��ıȽ���ȷ����(����)
ѡ�� | �ı����� | ��ƽ����ԭƽ��Ƚ� |
A | ����ѹǿ | N2��Ũ��һ����С |
B | �����¶� | N2��ת���ʱ�С |
C | ����һ����H2 | H2��ת���ʲ��䣬N2��ת���ʱ�� |
D | ʹ���ʵ����� | NH3������������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com