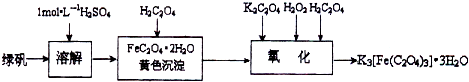
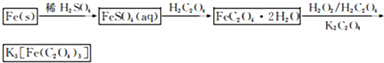
K
3[Fe(C
2O
4)
3]?3H
2O(三草酸合铁酸钾晶体)是制备负载型活性铁催化剂的主要原料.实验室利用(NH
4)2Fe(SO
4)
2?6H
2O(硫酸亚铁铵)、H
2C
2O
4(草酸)、K
2C
2O
4(草酸钾)、双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
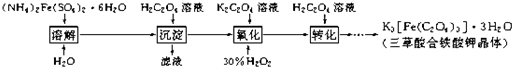
反应的原理为:
沉淀:(NH
4)2Fe(SO
4)
2?6H
2O+H
2C
2O
4═FeC
2O
4?2H
2O↓+(NH
4)2SO
4+H
2SO
4+4H
2O
氧化:6FeC
2O
4+3H
2O
2+6K
2C
2O
4═4K
3[Fe(C
2O
4)
3]+2Fe(OH)
3转化:2Fe(OH)
3+3H
2C
2O
4+3K
2C
2O
4═2K
3[Fe(C
2O
4)
3]+6H
2O
(1)溶解的过程中要加入几滴稀硫酸,目的是
.
(2)沉淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是
.
(3)在沉淀中加入饱和K
2C
2O
4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H
2O
2溶液,不断搅拌.此过程需保持温度在40℃左右,可能的原因是
.
(4)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H
2SO
4酸化,滴加KMnO
4溶液至草酸根离子恰好全部氧化成二氧化碳.向反应后的溶液中加入足量锌粉,加热至黄色消失.然后过滤、洗涤,将滤液及洗涤液一并转入锥形瓶,此时溶液仍呈酸性.
步骤三:用标准KMnO
4溶液滴定步骤二所得溶液至终点,记录消耗KMnO
4溶液的体积(滴定中Mn
O4-被还原成Mn
2+).
步骤四:….
步骤五:计算,得出结论.
请回答下列问题:
①步骤一中需要用到的玻璃仪器有烧杯、量筒、玻璃棒、
、
.
②步骤二中若加入KMnO
4的量不足,则测得铁含量
(填“偏低”“偏高”或“不变”);加入锌粉的目的是
.
③写出步骤三中发生反应的离子方程式:
.
④请补充步骤四的操作:
.




 阅读快车系列答案
阅读快车系列答案
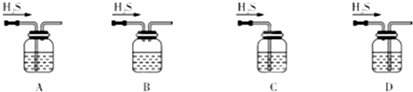
 图所示装置的减压过滤与母液分离.
图所示装置的减压过滤与母液分离.