
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
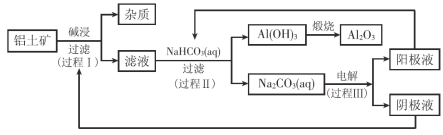
(1)过程I,发生反应的离子方程式是 。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
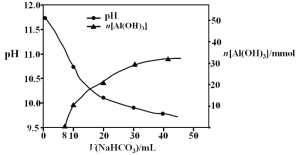
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是 。
② 过程II生成Al(OH)3的离子方程式是 。
(3)过程III,电解Na2CO3溶液的装置如下图所示。
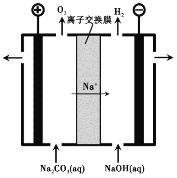
① 阴极的电极反应式是 。
② 简述阳极液生成的原理: 。
【答案】
(1)Al2O3+2OH-=2AlO2-+H2O
(2)①OH-+HCO3-=CO32-+H2O;②HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
(3)①2H2O+2e-=2OH-+H2↑;②2H2O-4e-=O2↑+4H+,溶液中c(H+)增大,发生反应:CO32-+H+=HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液
【解析】
试题分析:(1)过程I,铝土矿中氧化铝与碱反应生成偏铝酸钠根离子和水,反应的离子方程式为Al2O3 + 2OH-= 2AlO2-+ H2O,故答案为:Al2O3 + 2OH-= 2AlO2-+ H2O;
(2)① 加入NaHCO3溶液体积小于8 mL时,没有氢氧化铝沉淀生成,主要反应的离子方程式为OH- + HCO3-= CO32-+ H2O,故答案为:OH- + HCO3-= CO32-+ H2O;
② 过程II中碳酸氢根离子与偏铝酸钠根离子发生复分解反应,生成氢氧化铝沉淀和碳酸根,生成Al(OH)3的离子方程式为HCO3-+ AlO2-+ H2O = Al(OH)3↓+ CO32-,故答案为:HCO3-+ AlO2-+ H2O = Al(OH)3↓+ CO32-;
(3)①根据图像,阴极放出氢气,溶液中的水放电,电极反应式为2H2O + 2e-= 2OH-+ H2↑,故答案为:2H2O + 2e-= 2OH-+ H2↑;
②2H2O - 4e-= O2↑+ 4H+,溶液中c(H+)增大,发生反应:CO32-+ H+ = HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液,故答案为:2H2O - 4e-= O2↑+ 4H+,溶液中c(H+)增大,发生反应:CO32-+ H+ = HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液。


科目:高中化学 来源: 题型:
【题目】下列实验基本操作正确的是( )
A.手持试管给试管里的物质加热
B.用燃着的酒精灯去引燃另一盏酒精灯
C.用天平称取药品时用手直接拿砝码
D.用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示实验装置及说法中正确的是( )
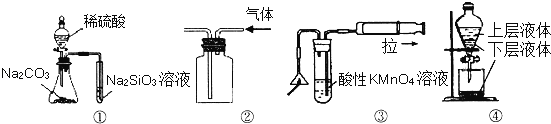
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③可以检验火柴燃烧生成的SO2气体
D.用图④提取海带中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于过滤操作的说法中,错误的是( )
A.玻璃棒下端要靠在三层滤纸处
B.滤纸边缘低于漏斗边缘,多余部分要剪去,并用水润湿贴紧,不留气泡
C.过滤时将液体沿玻璃棒注入过滤器,并使液面高于滤纸边缘
D.漏斗下端紧靠烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 中心区:Fe–2e—==Fe2+
C. 边缘处:O2+2H2O+4e—==4OH—
D. 交界处:4Fe2++O2+10H2O==4Fe(OH)3+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO3- ⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示装置进行实验,请回答下列问题:

Ⅰ.(1)若通入SO2气体,请填写表中空格:
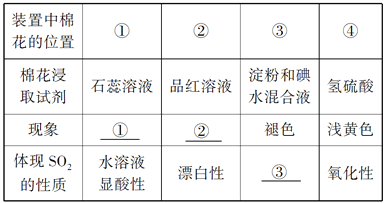
①________________ ②________________ ③________________
(2)写出③中反应的离子方程式:__________________________。
Ⅱ.若通入HCl气体,装置中的四处棉花依次做了如下处理:①包有用水润湿的某固体物质;②浸有KI溶液;③浸有石蕊溶液;④浸有浓NaOH溶液。请回答:
(1)观察到②处有棕黄色物质产生,则:①处包有的某固体物质可能是下列的________(填序号),其反应的离子方程式为________________________。
a.MnO2 b.KMnO4 c.KCl d.Cu
(2)实验过程中,在③处能观察到___________________________。
(3) 实验室一般用二氧化锰与浓盐酸反应制取氯气,当生成7.1gCl2时,被氧化的HCl的物质的量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。
① m、p、r是由这些元素组成的二元化合物;
② n是元素Z的单质,通常为黄绿色气体;
③ q具有强氧化性,q的水溶液常用于漂白和杀菌;
④ 0.01 mol·L1r溶液的pH为2,p是最简单的有机物,s通常是难溶于水的混合物。
上述物质的转化关系如图所示,回答下列问题。
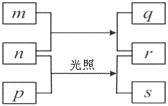
(1)Y原子的结构示意简图是 。
(2)X、Y、Z的原子半径由大到小的顺序是 (用元素符号表示)。
(3)r的电子式为 ;物质n的用途有 (任写一种即可)。
(4)q与等物质的量的NaOH反应后得到的溶液呈碱性的原因是 (用离子方程式表示)。
(5)W、X、Y按原子个数比为2 :1 :1组成化合物t能与NaHCO3溶液反应产生气泡(质谱分析法测得t的相对分子质量为60),化合物t是 (写名称)。
(6)常温常压下2.4g的p完全燃烧放出133.6kJ的热量,该反应的热化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com