
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.原子核内有10个中子的氧原子:18O B.乙烯的结构简式: CH2CH2

 C.CH4 分子的比例模型: D.-CH3(甲基)的电子式为:
C.CH4 分子的比例模型: D.-CH3(甲基)的电子式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.在某盐溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液
B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
C.在某溶液中加入盐酸酸化的BaCl2溶液,如果生成白色沉淀,则原溶液中一定
有SO42—
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
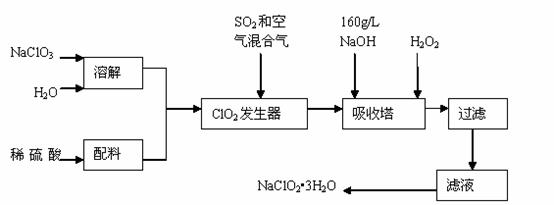
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 某温度时,1L 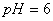 的纯水,含
的纯水,含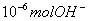 离子
离子
B. 含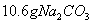 溶液中,所
溶液中,所 含阴离子总数等于
含阴离子总数等于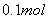
C. 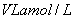
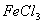 溶液中,若
溶液中,若 离子数目为
离子数目为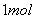 ,则
,则 离子数目大于
离子数目大于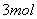
D. 电解精炼粗铜时,每转移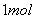 电子,阳极上溶解的
电子,阳极上溶解的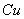 原子数必为
原子数必为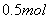
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
| 装置(气密性良好,试剂已添加) | 操作 | 现象 |
|
| 打开分液漏斗活塞,逐滴加入浓氨水 | ⅰ.C中气体颜色变浅 ⅱ.稍后,C中出现白烟并逐渐增多 |
浓氨水分解可以制氨气,写出A中反应的化学方程式是 。
是从平衡移动的角度分析NaOH固体在氨水分解中的作用
。
(2)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)= N2(g)+6HCl(g) H= —456 kJ·mol-1
已知:
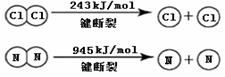
①NH3的电子式是 。
②断开1mol H-N键与断开1molH-Cl键所需能量相差约为 ,
(3)现象ⅱ中产生白烟的化学方程式是 。
(4)为避免生成白烟,该学生设计了下图装置以完成Cl2和NH3的反应。
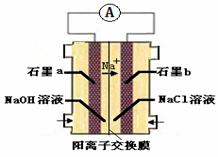
若该装置能实现设计目标,则①石墨b电极上发生的是 反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com