
ijͬѧģ�ҵ���۵���ȷ�������������ˮ��ԭ�������������о���
| װ�ã����������ã��Լ������ӣ� | ���� | ���� |
|
| ��Һ©����������μ���Ũ��ˮ | ����C��������ɫ��dz �����Ժ�C�г��ְ��̲������� |
Ũ��ˮ�ֽ�����ư�����д��A�з�Ӧ�Ļ�ѧ����ʽ�� ��
�Ǵ�ƽ���ƶ��ĽǶȷ���NaOH�����ڰ�ˮ�ֽ��е�����
��
��2������C�з����ķ�ӦΪ��2NH3(g)��3Cl2(g)�� N2(g)��6HCl(g) H= ��456 kJ��mol-1
��֪��
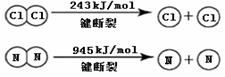
��NH3�ĵ���ʽ�� ��
�ڶϿ�1mol H��N����Ͽ�1molH��Cl�������������ԼΪ ��
��3�������в������̵Ļ�ѧ����ʽ�� ��
��4��Ϊ�������ɰ��̣���ѧ���������ͼװ�������Cl2��NH3�ķ�Ӧ��
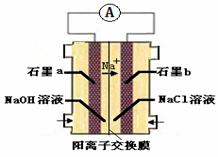
����װ����ʵ�����Ŀ�꣬���ʯīb�缫�Ϸ������� ��Ӧ�����������ԭ����
��д��ʯīa�缫�ĵ缫��Ӧʽ�� ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȫ�ۻ�����������������Һ�У����ᷢ����Ӧ���� �� ��
A��ϡ���� B������ͭ C��ϡ���� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Դת�������У���Ⱦ�ϴ����
A. ���ܷ��� B. ȼú���� C. �����ܷ��� D. ̫���ܷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ��ˮ�д��ڵ���ƽ�⣺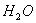

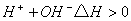 ������������ȷ����
������������ȷ����
A. ��ˮ���ȣ�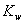 ����
����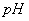 ����B. ��ˮ�м�������
����B. ��ˮ�м�������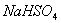 ���壬
���壬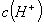 ����
����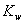 ����
����
C. ��ˮ�м�������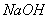 ���壬ƽ�������ƶ���
���壬ƽ�������ƶ���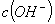 ����
����
D. ��ˮ�м�������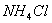 ���壬ƽ�������ƶ���
���壬ƽ�������ƶ���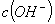 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н���ʵ��Ӧ�õ�ԭ������ʽ�У�����ȷ����
A. ���ű���ʳ��ˮ���ռ�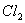 ��
��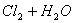

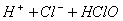
B. �ȵĴ�����Һ������ǿ��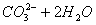

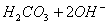
C. ��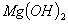 ����Һ�м���
����Һ�м���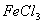 ��Һ��
��Һ�� 
D. ����FeCl3��ҺʱΪ��ֹ��Һ���dz���������ϡ����Fe3++3H2O Fe(OH)3+3H+,
Fe(OH)3+3H+,
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ϊ�������ݿ��ŵ��� ( )
A. ij��ˮ��pHΪ5��6
B��ij����ʯ��ˮ��Ũ����2��0 mol/l
C��ij�������ӵ�ֱ����160 nm
D��ij����������ܶ�Ϊ1��8 g��/cm3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ���� ( )
A��һ����������1 L������ͨ��46 g NO2����NO2�����ʵ���Ũ��һ��Ϊ1 mol��l
B����״���£�22��4 l�ļ�������20X6��02 X 1023��ԭ��
C��1 mol��������ˮת��6��02X 1023��e��
D��0��1 mol CH5+��6��02 X lO23��eһ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2012��3��22���ǵڶ�ʮ�조����ˮ�ա�������ˮ��Դ����������!
(1)C102��C12(��ԭ���ﶼΪClһ)�������г��õ��������������ĵ����ʵ�������������ʱ��C102������Ч����C12�� ����
(2)����ˮ�����ø�������(Na2Fe04��ǿ������)����ˮ�ʡ�����������������ɱ������ͬʱ����ˮ���õ�ԭ���� ��
(3)ij��ɫ��ˮ�п��ܺ���Fe3+��A13+��Mg2+��Na+��NO3-��CO32һ��SO42-�����еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100 mL������������ʵ�飬��������й�������ͼ��ʾ��
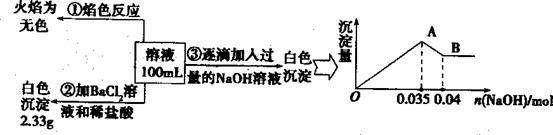
�������ͼ�ش��������⣺
��ʵ����������1��0 mol��l��NaOH��Һ80 ml�������������˲�������������ƽ����Ͳ��ҩ�ס��ձ�����ͷ�ιܣ���ȱ�ٵ�����Ϊ
��ʵ����г�������A��B��������������Ӧ�����ӷ���ʽΪ ��
����ȷ��NO3-�Ƿ����? (����ڡ��������ڡ���ȷ����)�������ڣ��Լ��� c(NO3-) (�������ڣ����ʲ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ��װ�ý��е�ʵ���У����ܴﵽ��Ӧʵ��Ŀ�ĵ���
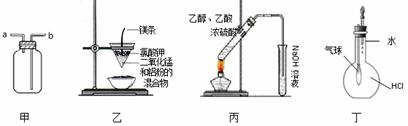
A��װ�üף������a�ڽ��룬�ռ�NH3
B��װ���ң����Ƶý�����
C��װ�ñ���ʵ������ȡ��������
D��װ�ö�����֤HCl������ˮ�е��ܽ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com