
【题目】W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界。
(1)W原子价电子的轨道表达式为_____________。
(2)WX的等电子体有N2、_______等。WN-与WX均为配合物中常见的配体,WN-作配体时,提供孤电子对的通常是W原子而不是氮原子,其原因是_________。
(3)ZX2的空间构型是______________。
(4)YF4遇水易发生水解,水解后产生的HF与部分YF4生成配离子YF62-,其反应的化学方程式为:3YF4+4H2O=H4YO4+2H2YF6。该反应混合物中,中心原子杂化方式相同的分子是_________。
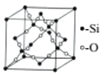
(5)一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到。其中硅原子的配位数为_______;己知该晶体的密度为ag/cm3,则该晶胞的棱长为______pm(用含a 、NA的代数式表示)。
【答案】 ![]() CN-(或NO+等) 碳元素的电负性小于氮元素的电负性 V形 SiF4、H2O、H4SiO4 4
CN-(或NO+等) 碳元素的电负性小于氮元素的电负性 V形 SiF4、H2O、H4SiO4 4 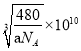
【解析】试题分析:本题以元素推断结果为载体,考查价电子的轨道式、等电子体、配合物知识、分子空间构型、原子杂化、晶体结构知识。
解析:以W-W链化合物构成了生命界的是C元素形成的有机物,所以W是C元素,则Y为Si元素,Y元素以Y-X-Y链化合物构成了矿物界是指矿物存在的Si—O—Si链,这也证明前一推断的正确性,则X为O,Z为S。
(1)C是6号元素,核外电子排布式为1s22s22p2,价电子为2s22p2,价电子轨道式为![]() 。正确答案:
。正确答案:![]() 。(2)WX是CO,原子数相等、价电子数相等的粒子包括N2、CN-、C22-等。CN-在形成配体时,由于C原子电负性比N原子电负性小,所以C原子对电子对的吸引能力较弱,也就比较容易提供用于形成配位键。正确答案:CN-(或C22-等)、碳元素的电负性小于氮元素的电负性。(3)ZX2是SO2,S原子成键电子对数目为2,孤对电子对数为(6-2×2)/2=1,价层电子对数为3,S采用sp2杂化,有一个杂化轨道容纳孤对电子,所以SO2空间构型为V形。正确答案:V形。(4)反应混合物中涉及SiF4、H2O、H4SiO4、H2SiF6四种物质,SiF4中心原子Si采用sp3杂化,H2O中心原子O采用sp3杂化,H4SiO4中心原子Si采用sp3杂化,H2SiF6中心原子Si采用sp3d2杂化。正确答案:SiF4、H2O、H4SiO4。(5)每1个Si原子周围相邻的O原子有4个,所以Si的配位数是4。晶胞中Si原子数8×1/8+6×1/2+4=8,O原子数16,晶胞总质量
。(2)WX是CO,原子数相等、价电子数相等的粒子包括N2、CN-、C22-等。CN-在形成配体时,由于C原子电负性比N原子电负性小,所以C原子对电子对的吸引能力较弱,也就比较容易提供用于形成配位键。正确答案:CN-(或C22-等)、碳元素的电负性小于氮元素的电负性。(3)ZX2是SO2,S原子成键电子对数目为2,孤对电子对数为(6-2×2)/2=1,价层电子对数为3,S采用sp2杂化,有一个杂化轨道容纳孤对电子,所以SO2空间构型为V形。正确答案:V形。(4)反应混合物中涉及SiF4、H2O、H4SiO4、H2SiF6四种物质,SiF4中心原子Si采用sp3杂化,H2O中心原子O采用sp3杂化,H4SiO4中心原子Si采用sp3杂化,H2SiF6中心原子Si采用sp3d2杂化。正确答案:SiF4、H2O、H4SiO4。(5)每1个Si原子周围相邻的O原子有4个,所以Si的配位数是4。晶胞中Si原子数8×1/8+6×1/2+4=8,O原子数16,晶胞总质量![]() ,设晶胞边长x pm,晶胞体积(x×10-10cm)3=x3×10-30cm3,
,设晶胞边长x pm,晶胞体积(x×10-10cm)3=x3×10-30cm3,
晶胞密度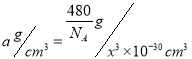 ,所以
,所以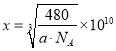 。正确答案:
。正确答案: 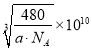 。
。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价)。则下列说法中不正确的是

A. 生成氢气的质量:X﹥Y B. 相对原子质量:X﹥Y
C. 金属活动性:Y﹥X D. 消耗硫酸的质量:X﹥Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中能大量共存的一组离子是( )
A.Na+、Al3+、Cl﹣、CO32﹣
B.H+、Na+、Fe2+、MnO4﹣
C.K+、Ca2+、Cl﹣、NO3﹣
D.K+、NH4+、OH﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生能量而存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①下图能表示该反应过程中能量变化的是________(填字母)。
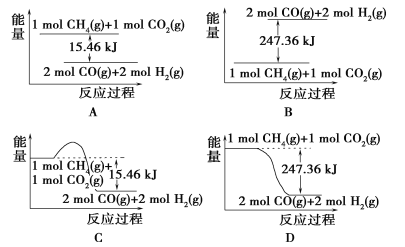
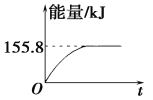
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成C与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态C合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国宋代《开宝本草》记载了“铁华粉”的制法:“取钢煅作叶,如笏或团,平面磨错,令光净.以盐水洒之,醋瓮中阴处埋之,一百日,铁上衣生,铁华成矣.”这里的“铁华粉”是指( )
A.醋酸亚铁
B.硫酸亚铁
C.氧化铁
D.氯化铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com