
【题目】现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价)。则下列说法中不正确的是

A. 生成氢气的质量:X﹥Y B. 相对原子质量:X﹥Y
C. 金属活动性:Y﹥X D. 消耗硫酸的质量:X﹥Y
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
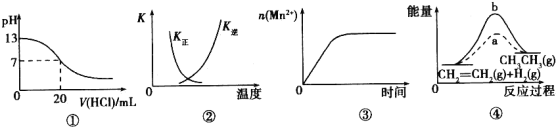
A.图①表示25℃时,用0.1 moI·L-1盐酸滴定20 mL0.l mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0, 正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0, 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.0l moI·L-1 KMnO4酸性溶液与过量的0.l moI·L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) △H<0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) △H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017枣阳市校级一模】下列保存物质的方法正确的是( )
A.保存液溴时向其中加入少量酒精,减少挥发
B.氢氟酸保存在塑料塞的玻璃瓶中,防止瓶口和塞子粘住
C.氨水易挥发,应密封在低温处保存
D.金属锂应保存在煤油中,防止被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不相同,分别如(I)和(Ⅱ)所示,

试回答:
(1)B中反应的化学方程式为___________________________。
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是______________。
(3)D中反应的化学方程式为______________________________。
(4)装置(I)的主要缺点是_______________________。
(5)装置(Ⅱ)的主要缺点是______________________________,如果选用此装置来完成实验,则必须采取的改进措施是:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,
KOH作为电解质。下列关于该燃料电池的叙述不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4+4OH--4e - =N2+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是( )
A. 油脂的种类很多,但它们水解后都一定有一产物相同
B. 淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体
C. 已知CH4+H2O![]() CH3OH+H2,该反应的有机产物是无毒物质
CH3OH+H2,该反应的有机产物是无毒物质
D. C(CH3)4的二氯代物只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实。[18]-轮烯是一种大环轮烯,其结构简式如图所示。 有关它的说法正确的是
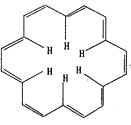
A. [18]- 轮烯分子中所有原子不可能处于同一平面
B. [18]- 轮烯的分子式为:C18H12
C. 1 mol[18]- 轮烯最多可与9 mol氢气发生加成反应生成环烷烃
D. [18]- 轮烯与乙烯互为同系物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
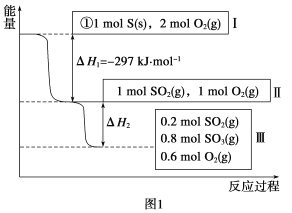
①写出能表示硫的燃烧热的热化学方程式:________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
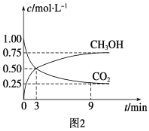
②能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%。在用丙炔合成2-甲基丙烯酸甲酯(![]() )的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物,这些物质可以是
)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物,这些物质可以是
A.CO和CH3OH B.CO2和H2O C.H2和CO D.CH3OH和H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com