
【题目】SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理SO2的烟气,流程如下:
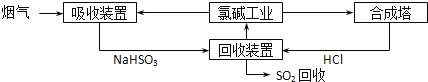
①“吸收装置”中发生反应的离子方程式_____________________。
②合成塔中每合成1mol气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式_____________。
③上述流程中循环利用的物质是____________________。
(2)方法二:利用FeCl3溶液氧化吸收烟气中SO2
①该反应的离子方程式________________________(反应a)。为验证该反应,同学们将SO2通入0.05mol/LFeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。关于红褐色液体,以下是同学们的分析推测与实验。
分析推测 | 实验步骤及现象 |
甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
②利用胶体的_________________(填性质)可以检验步骤I中是否得到了Fe(OH)3胶体。
③根据反应b说明步骤II中液体颜色变化的原因是______________________(用离子方程式及必要的文字说明)。
【答案】(1)①SO2+OH-=HSO3-;
②H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ·mol-1;
③NaCl溶液。
(2)①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;②丁达尔效应
③加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动
【解析】
试题分析:(1)①分析流程和信息知吸收装置中SO2和氯碱工业产品之一NaOH溶液反应生成亚硫酸氢钠,离子方程式为SO2+OH-=HSO3-;②已知每合成1mol HCl放出热量92.3kJ,其热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ·mol-1;③回收装置中NaHSO3溶液与HCl反应生成NaCl溶液,NaCl溶液又是氯碱工业的原料,故循环利用的物质是NaCl溶液。
(2)①利用FeCl3溶液的氧化性吸收烟气中的SO2,SO2在溶液中被氧化为SO42-,同时Fe3+被还原为Fe2+,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;②丁达尔效应是检验胶体的常用方法;③Fe3+能被铁粉还原为Fe2+,2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )

A.该反应的化学方程式为3B+4D ![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述错误的是( )
A.大气中PM2.5比表面积大,吸附力强,能吸附许多有毒有害物质
B.在厨房里可用米汤检验加碘食盐中的碘
C.14C可用于文物年代的鉴定,14C与12C互为同位素
D.喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉与漂白液可用于杀菌消毒,下列说法中正确的是
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉
D. 漂白液的有效成分是Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行体检时,发现在体检的血液化验单中,有如下一项内容:葡萄糖5.9×10-3mol/L。表示该体检指标的物理量是
A. 溶解度(S) B. 溶质的质量分数(w) C. 物质的量浓度(c) D. 摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是
A. 天然气、酒精分别属于化石能源、可再生能源
B. 金属在潮湿空气中生锈,主要是发生析氢腐蚀
C. NaClO具有强氧化性,可作织物漂白剂
D. 高纯硅广泛应用于太阳能电池和半导体材料的制造
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应①~④四个反应,回答下列问题:
①H2S+I2=S+2HI
②2FeCl2+Cl2=2FeCl3
③Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
④Cl2+2KI=2KCl+I2
(1)反应①的反应类型为(填序号) 。
A.置换反应 B.复分解反应
C.化合反应 D.氧化还原反应
(2)对于反应②,还原剂与氧化剂的物质的量之比为________。
(3)对于反应③,用双线桥法标明电子转移的方向和数目________________________,
(4)写出反应④的离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是
A. “从沙滩到用户”,计算机芯片材料是指单质硅
B. 从海水中提取物质不都通过化学反应才能实现
C. 煤经过气化、液化等化学变化可转变为清洁燃料
D. 新型材料聚酯纤维、光导纤维都属于有机高分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com