
【题目】制取聚合硫酸铁(PFS)的化学方程式如下
2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)(3-n/2)+(2-n)H2O,
下图是以回收废铁屑为原料制备PFS的一种工艺流程。
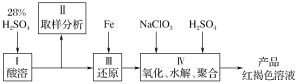
回答下列问题
(1)下列操作或描述正确的是________。
A.粉碎的目的是增大反应物接触面积,提高酸浸反应速率
B.酸浸中可以用硫酸、硝酸、盐酸等
C.反应釜中加入氧化剂,使Fe2+转化为Fe3+
D.减压蒸发的优点是降低蒸发温度,防止产物分解
(2)废铁屑使用前往往用________浸泡。
(3)废铁屑与酸发生多步反应,完成其中的化合反应的离子方程式______________________。
(4)聚合釜中溶液的pH必须控制在一定的范围内,目的是______________________。
(5)为了防止产物分解,必须采用减压蒸发,下列操作正确的是________。
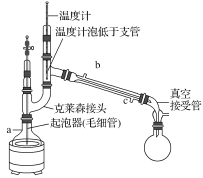
A.a为蒸馏烧瓶,b为冷凝管,c接自来水龙头
B.毛细管的作用和沸石相似,防止暴沸
C.随着温度计水银球高度提升,所得的气体的沸点升高
D.实验结束,先关闭冷凝管,再关闭真空泵
【答案】ACD )热的Na2CO3溶液 Fe+2Fe3+=3Fe2+ 促使Fe3+部分水解生成Fe2(OH)n(SO4)(3-n/2) BC
【解析】
(1)A、粉碎的目的是增大反应物接触面积,提高酸浸反应速率;
B.生成硫酸盐,只能用硫酸;
C.加入氧化剂使Fe2+转化为Fe3+;
D.减压蒸发的优点是降低蒸发温度,防止产物分解;
(2) Na2CO3水解显碱性;
(3)工业废铁屑中一部分已经生锈生成了Fe2O3,溶于酸有生成Fe3+;
(4)调节pH促使Fe3+部分水解生成Fe2(OH)n(SO4)(3-n/2);
(5)A.a为烧瓶,b为冷凝管,c接自来水龙头;
B.毛细管的作用和沸石相似,防止暴沸;
C.越往上温度越低,要达到相同的温度,收集到的气体的沸点升高;
D.实验结束,不要先关闭冷凝管,反应容器中还有气体产生,待冷却后关闭。
(1)A、粉碎的目的是增大反应物接触面积,提高酸浸反应速率,选项A正确;
B.根据所得产品可知,生成硫酸盐,只能用硫酸,选项B错误;
C.Fe2(OH)n(SO4)(3-n/2)中Fe是+3价,加入氧化剂使Fe2+转化为Fe3+,选项C正确;
D.减压蒸发的优点是降低蒸发温度,防止产物分解,选项D正确。
答案选ACD;
(2) Na2CO3水解显碱性,工业废铁屑中含有油污,使用前要用热的Na2CO3溶液浸泡除去;
(3)工业废铁屑中一部分已经生锈生成了Fe2O3,溶于酸有生成Fe3+,化合反应的离子方程式Fe+2Fe3+=3Fe2+;
(4)调节pH促使Fe3+部分水解生成Fe2(OH)n(SO4)(3-n/2),偏大偏小都会影响n的值;
(5)A.a为烧瓶,b为冷凝管,c接自来水龙头,选项A错误;
B.毛细管的作用和沸石相似,防止暴沸,选项B正确;
C.越往上温度越低,要达到相同的温度,收集到的气体的沸点升高,选项C正确;
D.实验结束,不要先关闭冷凝管,反应容器中还有气体产生,待冷却后关闭,选项D错误。
答案选BC。


科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-△H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c (H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体,  增大
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4B.α2+α3<1
C.2p1=2p3<p2D.达到平衡时丙容器中NH3的体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是
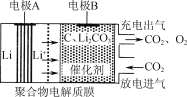
A.该电池放电时的正极反应为2Li-2e-+CO32-=Li2CO3
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-=3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,判断下列叙述中正确的是
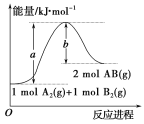
A.该反应的活化能是b kJ/mol
B.该反应热ΔH=+(a-b)kJ/mol
C.该反应中反应物的总能量高于生成物的总能量
D.1molA2(g)和1molB2(g)的能量总和是akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向温度为300℃的2L密闭容器中充入2molSO2和1molO2发生反应:![]() ,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
A. 该温度下反应的平衡常数K=1620
B. SO2和O2的平衡转化率相等
C. 平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数不变
D. 若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是__g;
(2)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为__mol/L;
(3)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了__性和__性,则56gFe参加反应时,被还原的HNO3为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
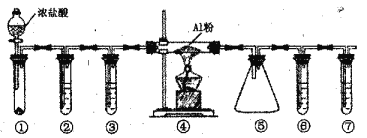
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com