
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4B.α2+α3<1
C.2p1=2p3<p2D.达到平衡时丙容器中NH3的体积分数最大
科目:高中化学 来源: 题型:
【题目】已知:TK时,Ca(OH)2、CaWO4都微溶于水。pCa=-lgc(Ca2+),pX=-lgc(WO42-)或-lgc(OH-)。TK时CaWO4、Ca(OH)2的沉淀溶解平衡曲线如图所示。
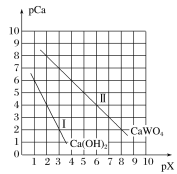
(1)①向Na2WO4溶液中加入饱和石灰水,现象为__,离子方程式为:__。
②Na2WO4溶液和石灰乳混合,会产生大量的CaWO4,则该反应的平衡常数K=__。
(2)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,钼酸钠晶体(Na2MoO4·2H2O)是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的![]() =__(结果保留2位有效数字)。
=__(结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2mol![]() 和
和![]() 充入10L恒容密闭容器中,发生反应
充入10L恒容密闭容器中,发生反应![]() ,5min时达到平衡,测得反应放热
,5min时达到平衡,测得反应放热![]() 下列说法错误的是
下列说法错误的是![]()
A.![]() 内,用
内,用![]() 表示的平均反应速率
表示的平均反应速率![]()
![]()
B.反应物浓度的比值不变时,该反应达到平衡状态
C.若增大![]() 的浓度,
的浓度,![]() 的转化率增大
的转化率增大
D.条件不变,若起始时充入4mol![]() 和
和![]() ,平衡时放出的热量大于
,平衡时放出的热量大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由镁铝合金制取MgSO4·7H2O的工艺流程如下图:
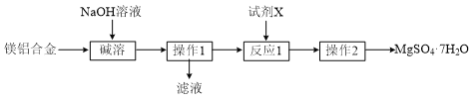
(1)“碱溶”的离子方程式为_______。
(2)“操作1”的名称为_______。
(3)试剂X的名称为_______。
(4)“操作2”含“加热浓缩、降温结晶、过滤、乙醇洗涤、干燥”,用乙醇洗涤的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干电池的工作原理如图所示,总反应为:![]() ,下列说法正确的是
,下列说法正确的是
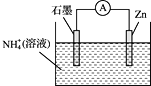
A.石墨为电池的负极
B.电池工作时![]() 被氧化
被氧化
C.实现了电能向化学能转化
D.电子由Zn电极经外电路流向石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl36H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl36H2O。下列实验原理和装置不能达到实验目的的是( )
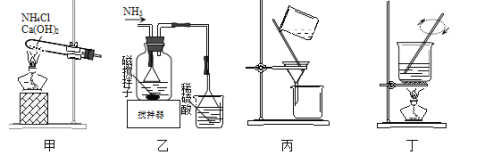
A.用装置甲制备NH3B.用装置乙制备Cu(NH3)4Cl2并沉铁
C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3D.用装置丁将FeCl3溶液蒸干制备FeCl36H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合成材料的说法中,错误的是
A.聚氯乙烯可制成薄膜、软管等,其单体是CH2=CHCl
B.锦纶![]() 的单体是H2N(CH2)6NH2和HOOC(CH2)4COOH
的单体是H2N(CH2)6NH2和HOOC(CH2)4COOH
C.合成酚醛树脂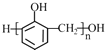 的单体是苯酚和甲醇
的单体是苯酚和甲醇
D.合成顺丁橡胶![]() 的单体是CH2=CH﹣CH=CH2
的单体是CH2=CH﹣CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取聚合硫酸铁(PFS)的化学方程式如下
2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)(3-n/2)+(2-n)H2O,
下图是以回收废铁屑为原料制备PFS的一种工艺流程。
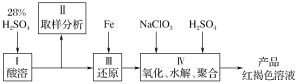
回答下列问题
(1)下列操作或描述正确的是________。
A.粉碎的目的是增大反应物接触面积,提高酸浸反应速率
B.酸浸中可以用硫酸、硝酸、盐酸等
C.反应釜中加入氧化剂,使Fe2+转化为Fe3+
D.减压蒸发的优点是降低蒸发温度,防止产物分解
(2)废铁屑使用前往往用________浸泡。
(3)废铁屑与酸发生多步反应,完成其中的化合反应的离子方程式______________________。
(4)聚合釜中溶液的pH必须控制在一定的范围内,目的是______________________。
(5)为了防止产物分解,必须采用减压蒸发,下列操作正确的是________。
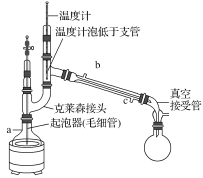
A.a为蒸馏烧瓶,b为冷凝管,c接自来水龙头
B.毛细管的作用和沸石相似,防止暴沸
C.随着温度计水银球高度提升,所得的气体的沸点升高
D.实验结束,先关闭冷凝管,再关闭真空泵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)常用作有机合成的氯化剂、催化剂和阻燃剂等。POCl3遇水会强烈水解,生成H3PO4和HCl。为测定某POCl3样品中Cl元素含量,进行下列实验:
①准确称取30.70 g POCl3样品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00 mL溶液A,取10.00 mL溶液A于锥形瓶中;
③加入10.00 mL 3.200 mol·L-1 AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④加入指示剂,用0.200 0 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12,Ksp(AgCl)=1.8×10-10。
(1) 滴定选用的指示剂是________ (填字母);滴定终点的现象为________。
A. FeCl2 B. NH4Fe(SO4)2 C. 淀粉 D. 甲基橙
(2) 用硝基苯覆盖沉淀的目的是________;若无此操作,所测Cl元素含量将会________ (填“偏大”、“偏小”或“不变”)。
(3) 计算三氯氧磷样品中Cl元素的含量________ (写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com