
【题目】三氯氧磷(POCl3)常用作有机合成的氯化剂、催化剂和阻燃剂等。POCl3遇水会强烈水解,生成H3PO4和HCl。为测定某POCl3样品中Cl元素含量,进行下列实验:
①准确称取30.70 g POCl3样品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00 mL溶液A,取10.00 mL溶液A于锥形瓶中;
③加入10.00 mL 3.200 mol·L-1 AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④加入指示剂,用0.200 0 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12,Ksp(AgCl)=1.8×10-10。
(1) 滴定选用的指示剂是________ (填字母);滴定终点的现象为________。
A. FeCl2 B. NH4Fe(SO4)2 C. 淀粉 D. 甲基橙
(2) 用硝基苯覆盖沉淀的目的是________;若无此操作,所测Cl元素含量将会________ (填“偏大”、“偏小”或“不变”)。
(3) 计算三氯氧磷样品中Cl元素的含量________ (写出计算过程)。
【答案】B 当最后一滴标准KSCN溶液滴入时,溶液变为血红色,且半分钟不褪去 使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应(或防止沉淀转化生成AgSCN而导致数据不准确) 偏小 先后发生的反应:POCl3+3H2O=H3PO4+3HCl、Cl-+Ag+=AgCl↓、SCN-+Ag+=AgSCN↓;
n(AgNO3)总=3.200 mol·L-1×10.00×10-3 L=3.200×10-2 mol;
n(Ag+)剩余=n(SCN-)=0.200 0 mol·L-1×10.00×10-3 L=2.000×10-3 mol;
与Cl-反应的n(Ag+)=n(AgNO3)总-n(Ag+)剩余=0.030 mol;
m(Cl元素)=0.030 mol×35.5 mol·L-1=1.065 g;
w(Cl元素)=![]() ×100%=34.69%。
×100%=34.69%。
【解析】
该滴定原理为:先将POCl3样品彻底水解,氯元素全部以Cl-形式存在,取样,然后加入硝酸银标准液,将银离子沉淀,然后再滴加KSCN标准液,测定剩余银离子的量,从而确定氯离子消耗的银离子的量,得到氯离子的量;加入硝酸银时加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖,以防用KSCN溶液滴定剩余硝酸银时氯化银转化为AgSCN,使滴定结果不准。
(1)滴定终点时,KSCN过量,所以选用的指示剂应能和SCN-反应使溶液变色,Fe3+与SCN-反应溶液变红色,所以选NH4Fe(SO4)2为指示剂,滴定终点,可观察到最后一滴标准液KSCN溶液滴入时,溶液变为血红色,且半分钟不褪去;
(2)根据题目信息可知AgSCN沉淀的溶解度比AgCl小,KSCN溶液直接与氯化银接触会发生沉淀转化,导致滴定结果不准确;加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应(或防止沉淀转化生成AgSCN而导致数据不准确);如果不进行此操作,消耗的KSCN溶液偏多,根据滴定原理可知会导致样品中氯元素的含量偏小;
(3)先后发生的反应:POCl3+3H2O=H3PO4+3HCl、Cl-+Ag+=AgCl↓、SCN-+Ag+=AgSCN↓;
n(AgNO3)总=3.200 mol·L-1×10.00×10-3 L=3.200×10-2 mol;
n(Ag+)剩余=n(SCN-)=0.200 0 mol·L-1×10.00×10-3 L=2.000×10-3 mol;
与Cl-反应的n(Ag+)=n(AgNO3)总-n(Ag+)剩余=0.030 mol;
m(Cl元素)=0.030 mol×35.5 mol·L-1=1.065 g;
w(Cl元素)=![]() ×100%=34.69%。
×100%=34.69%。


科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4B.α2+α3<1
C.2p1=2p3<p2D.达到平衡时丙容器中NH3的体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向温度为300℃的2L密闭容器中充入2molSO2和1molO2发生反应:![]() ,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
A. 该温度下反应的平衡常数K=1620
B. SO2和O2的平衡转化率相等
C. 平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数不变
D. 若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是__g;
(2)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为__mol/L;
(3)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了__性和__性,则56gFe参加反应时,被还原的HNO3为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的合金及其配合物用途非常广泛。
(1) Co3+基态核外电子排布式为________。
(2) 一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为________。

(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________ (用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是________ (已知CO32-的结构式为![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
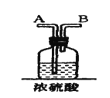
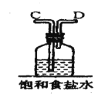
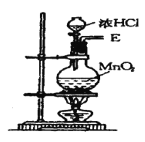
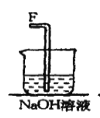
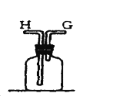
(1)该反应中生成氯气的化学方程式为:__。
(2)连接上述仪器的正确顺序是:(填各接口处的字母)E接___接___,___接___接___,___接__。___。
(3)在装置中,①饱和食盐水起的作用是__。
②浓硫酸起的作用是__。
③NaOH溶液的作用是__。
(4)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
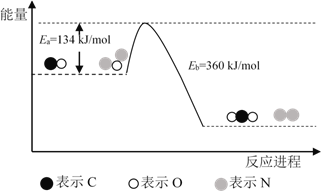
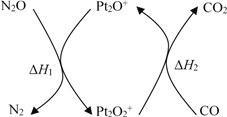
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
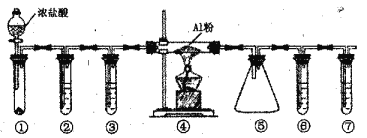
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com