
【题目】海水是镁的主要来源之一。从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。
(1)以上提取镁的全过程中,没有涉及的化学反应类型是 (填序号)。
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
(2)下列关于提取镁的说法中不正确的是 (填序号)。
A.此法的优点之一是原料来自大海
B.进行①②③步骤的目的是富集MgCl2
C.可用电解熔融氧化镁的方法制取镁
D.电解冶炼镁要消耗大量电能
(3)电解熔融氯化镁制取镁的化学反应方程式 。
(4)③中沉淀物与盐酸反应的离子反应方程式 。
【答案】(1)C(2)C(3)MgCl2(熔融)![]() Mg+Cl2↑,
Mg+Cl2↑,
(4)Mg(OH)2+2H+![]() Mg2++2H2O
Mg2++2H2O
【解析】
试题分析:(1)贝壳的主要成分为CaCO3,加热分解生成CaO,CaO和水发生化合反应生成Ca(OH)2,与MgCl2发生复分解反应生成Mg(OH)2,没有涉及置换反应,故答案为C;
(2)A.海水资源丰富,海水中含有大量的镁元素,故A正确;B.经过①②③步骤可得到MgCl2,故B正确;C.氧化镁高熔点,电解要消耗更多能源,通常电解熔融氯化镁的方法制取镁,故C错误;D.电解冶炼镁必然要消耗大量电能,故D正确;答案为C。
(3)电解熔融氯化镁制取镁的化学反应方程式为MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
(4)③中沉淀物为氢氧化镁,溶解于盐酸反应的离子反应方程式为Mg(OH)2+2H+![]() Mg2++ 2H2O。
Mg2++ 2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得溶液中加入0.2mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为
A. 1.0mol B. 1.2mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以环氧乙烷和布洛芬为主要原料,按下列路线合成药物布洛芬酰甘氨酸钠。

己知:(1)RCOOH ![]() RCOC1
RCOC1 ![]() RCOORˊ
RCOORˊ
(2)R-Cl- ![]() R-NH2
R-NH2 ![]() R-NH2HC1
R-NH2HC1 ![]() RCONHR
RCONHR
请回答:
(1)写出化合物的结构简式:B_________ ; D_________ 。
(2)下列说法不正确的是_________。
A.![]() 转化为A为氧化反应
转化为A为氧化反应
B. RCOOH与SOCl2反应的产物有SO2和HC1
C.化合物B能发生缩聚反应
D.布洛芬酰甘氨酸钠的分子式为C15H19NO3Na
(3)写出同时符合下列条件的布洛芬的所有同分异构体_________。
①红外光谱表明分子中含有酯基,实验发现能与NaOH溶液1∶2反应,也能发生银镜反应;
②H—NMR谱显示分子中有三个相同甲基,且苯环上只有一种化学环境的氢原子。
(4)写出F→布洛芬酰甘氨酸钠的化学方程式_________。
(5)利用题给信息,设计以![]() 为原料制备(
为原料制备(![]() )的合成路线(用流程图表示:无机试剂任选)_____________________。
)的合成路线(用流程图表示:无机试剂任选)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
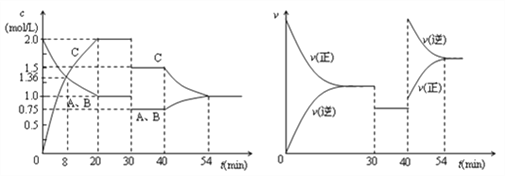
A. 前20min B的平均反应速率为0.05mol·L-1·min-1
B. 8 min时表示正反应速率等于逆反应速率
C. 反应方程式中的x=1,30 min时表示增大压强
D. 40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A. 光催化还原水制氢比电解水制氢更节能环保、更经济
B. 铁表面镀锌可增强其抗腐蚀性
C. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D. 制饭勺、饭盒、高压锅等的不锈钢是合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①②③分别为CO检测试纸 (浸有氯化钯洛液的滤纸,遇CO变黑色)、滴有品红溶液的滤纸、滴有酸性KMn04 溶液的滤纸,a和b分别为两个小气球。
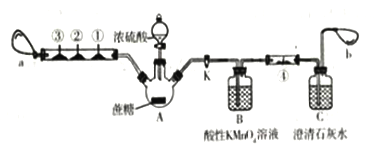
实验步骤如下:按图示连接好仪器,然后检查装置的气密性;装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
(1)上图中盛有浓硫酸的仪器名称为________。待上述反应结束后,点燃酒精灯并在②号和③号滤纸的玻璃管近均匀加热,观察到的现象是_______。
(2)B瓶中酸性KMnO4溶液的作用是______________,发生反应的离子方程式为_____。
(3)打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2。为了证明有CO2生成并简化实验装置,可在④号位置放上滴有______的滤纸(从以下试剂中选择)。
A.品红浓液 B.酸性高锰酸钾溶液 C.溴水 D.澄清石灰水
(4)若反应生成的两种碳的氧化物在相同条件下的体积比为2:1,则滤纸炭化后体积膨胀发生反应的化学方程式可能为_________。(若是氧化还原反应,请用单线桥法在化学反应方程式上标明电子转移的方向和数目。)
(5)若在尾端没有气球b,会有什么不良结果?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu放入0.1 molL﹣1FeCl3溶液中,反应一段时间后取出Cu片,溶液中Fe3+与Fe2+的物质的量浓度之比为4:3,则反应后溶液中Cu2+与Fe3+的物质的量之比为
A. 3:2 B. 3:8 C. 4:3 D. 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能光电池由于具有充电快、寿命长等特点,适于很多特殊环境和场合,现已得到广泛应用。氮化稼(GaN)光电池的结构如图所示。下列说法中正确的是( )

A. 该装置系统中只存在两种能量转化
B. Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O
C. 离子交换膜为质子交换膜,H+从右池移向左池
D. 常温下,当装置中有lmolCH4生成时,GaN电极有44.8LO2生成(不考虑O2的溶解性〕
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com