
【题目】1,4﹣环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出): 
(1)写出反应④、⑦的化学方程式:④;
⑦ .
(2)②的反应类型是 , 上述七个反应中属于加成反应的有(填反应序号).
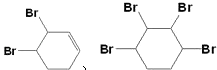
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为 .
【答案】
(1)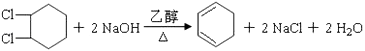 ;
;![]()
(2)消去反应;③⑤⑥
(3)
【解析】解:由转化关系可知A为 ![]() ,B为
,B为 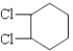 或溴代烃,C为
或溴代烃,C为 ![]() ,(1)B为
,(1)B为  ,在NaOH醇溶液中加热发生消去反应,反应的方程式为
,在NaOH醇溶液中加热发生消去反应,反应的方程式为 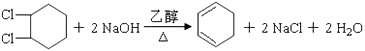 ,C为
,C为 ![]() ,在NaOH溶液中发生取代反应,反应的方程式为
,在NaOH溶液中发生取代反应,反应的方程式为 ![]() ,
,
故答案为: 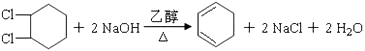 ;
; ![]() ;(2)由反应条件和物质的转化可知,反应①为取代反应,②为消去反应,③为加成反应,④为消去反应,⑤加成反应,⑥为加成反应,⑦为取代反应,故答案为:消去反应;③⑤⑥;(3)反应⑤可能与溴发生1,2加成或1,4加成,也可与2mol溴完全发生加成反应,除题中物质之外,还可能生成
;(2)由反应条件和物质的转化可知,反应①为取代反应,②为消去反应,③为加成反应,④为消去反应,⑤加成反应,⑥为加成反应,⑦为取代反应,故答案为:消去反应;③⑤⑥;(3)反应⑤可能与溴发生1,2加成或1,4加成,也可与2mol溴完全发生加成反应,除题中物质之外,还可能生成 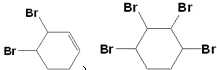 ,故答案为:
,故答案为:  .
.
由转化关系可知A为 ![]() ,B为
,B为  或溴代烃,C为
或溴代烃,C为 ![]() ,结合有机物的结构和性质以及题目要求解答该题.
,结合有机物的结构和性质以及题目要求解答该题.


科目:高中化学 来源: 题型:
【题目】已知A,B,C,D都是元素周期表中前36号的元素.A元素的一种核素没有中子;B的基态原子核外电子有7种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
(1)BA3分子的立体结构是形,该化合物易溶于水,原因可能是(填选项字母)
A.该化合物分子是极性分子
B.该化合物分子可与水分子之间形成氢键
C.该化合物分子在水溶液中部分与水发生反应
(2)BA3的熔点比CA4的熔点 , (填“高”或“低”)原因是 .
(3)D位于元素周期表中第族,它的+3价离子的检验方法是: .
(4)如图是由C单质构成的晶体的一个晶胞,若设该晶胞的边长为a cm,NA表示阿伏加德罗常数的值,则该晶体的密度是g/cm3 . (只要求列出算式). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.回答有关问题:
(1)从能量的角度看,断开化学键要 , 形成化学键要
(2)已知拆开1molH﹣H键、1molI﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修5:有机化学基础】端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应.2R﹣C≡C﹣H ![]() R﹣C≡C﹣C≡C﹣R+H2
R﹣C≡C﹣C≡C﹣R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值.下面是利用Glaser反应制备化合物E的一种合成路线: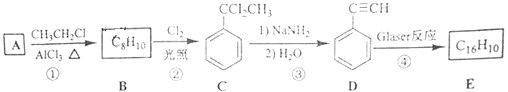
回答下列问题:
(1)B的结构简式为 , D的化学名称为 .
(2)①和③的反应类型分别为、 .
(3)E的结构简式为 . 用1mol E合成1,4﹣二苯基丁烷,理论上需要消耗氢气mol.
(4)化合物()也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式 .
(6)写出用2﹣苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种核素X的质量数为A,含N个中子,它与2H原子组成2HmX分子.在a g 2HmX中所含质子的物质的量是( )
A.![]() (A﹣N+m) mol
(A﹣N+m) mol
B.![]() (A﹣N) mol
(A﹣N) mol
C.![]() (A﹣N) mol
(A﹣N) mol
D.![]() (A﹣N+2m) mol
(A﹣N+2m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的锌与100mL18.5molL﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1molL﹣1 . 则生成的气体中SO2和H2的体积比为( )
A.1:2
B.2:1
C.1:4
D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与人类生活密切相关.下列物品与对应的材料相匹配的是( )
A.光导纤维﹣﹣硅酸盐材料
B.透明饮料瓶﹣﹣合金材料
C.纯棉织物﹣﹣合成纤维材料
D.橡胶轮胎﹣﹣有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途.
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,
①画出基态Cu原子的价电子轨道排布图;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因;
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4H2O晶体.
①沉淀溶解的离子方程式为;
②Cu(NH3)4SO4H2O晶体中存在的化学键有;
a.离子键 b.极性键 c.非极性键 d.配位键
③SO42﹣的立体构型是 , 其中S原子的杂化轨道类型是;
(3)Cu晶体中原子的堆积方式如图所示(为面心立方最密堆积),则晶胞中Cu原子的配位数为 , 若Cu晶体的晶胞参数a=361.4pm,则Cu晶体的密度是(只用数字列算式) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,R是短周期主族元素,X原子最外层电子数为电子总数的 ![]() ,Y原子最外层电子数是内层电子数的3倍, Z元素的单质常温下能与水反应产生氢气,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是( )
,Y原子最外层电子数是内层电子数的3倍, Z元素的单质常温下能与水反应产生氢气,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是( )
A.原子半径的大小顺序:X>Y>Z>R
B.氢化物的稳定性:X>Y
C.最高价氧化物的水化物的酸性:R>X
D.Y与Z形成的两种化合物中的化学键和晶体类型均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com