
【题目】铜及其化合物在科学研究和工业生产中具有许多用途.
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,
①画出基态Cu原子的价电子轨道排布图;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因;
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4H2O晶体.
①沉淀溶解的离子方程式为;
②Cu(NH3)4SO4H2O晶体中存在的化学键有;
a.离子键 b.极性键 c.非极性键 d.配位键
③SO42﹣的立体构型是 , 其中S原子的杂化轨道类型是;
(3)Cu晶体中原子的堆积方式如图所示(为面心立方最密堆积),则晶胞中Cu原子的配位数为 , 若Cu晶体的晶胞参数a=361.4pm,则Cu晶体的密度是(只用数字列算式) 
【答案】
(1)![]() ;Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO
;Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO
(2)Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣;a、b、d;正四面体;sp3
(3)12;![]()
【解析】解:(1)①Cu是29号元素,价层电子的排布为3d104s1 , 所以价电子轨道排布图为 ![]() ,
,
所以答案是: ![]() ;
;
②轨道中电子排布达到全满、半满、全空时原子最稳定,Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO,
所以答案是:Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO;(2)①向硫酸铜中加入氨水,得到的是氢氧化铜沉淀,故溶解氢氧化铜的原理与制取银铵溶液相似,故反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣ ,
所以答案是:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣;
②配合物中,中心离子与配体之间有配位键,内界和外界之间是离子键,氨分子和水分子中都有极性共价键,所以Cu(NH3)4SO4H2O晶体中存在的化学键有离子键、极性键、配位键,故选a、b、d;
③SO42﹣的中心原子硫原子的价层电子对数为 ![]() =4,没有孤电子对,所以SO42﹣的空间构型为正四面体,根据价层电子对互斥理论可知,S原子的杂化方式为sp3 ,
=4,没有孤电子对,所以SO42﹣的空间构型为正四面体,根据价层电子对互斥理论可知,S原子的杂化方式为sp3 ,
所以答案是:正四面体;sp3;(3)根据Cu晶体的晶胞结构示意图可知,以顶点铜原子为例,距离最近的铜原子位于晶胞的面心上,这样的原子有12个,所以晶胞中Cu原子的配位数为12,Cu晶体的晶胞中含有铜原子数为 ![]() =4,根据
=4,根据 ![]() 可知晶胞的密度为
可知晶胞的密度为 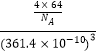 g/cm3=
g/cm3= ![]() g/cm3 ,
g/cm3 ,
所以答案是:12; ![]() .
.


科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式 .
(2)根据元素周期律,原子半径GaAs,第一电离能GaAs.(填“大于”或“小于”)
(3)AsCl3分子的立体构型为 , 其中As的杂化轨道类型为 .
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 .
(5)GaAs的熔点为1238℃,密度为ρ gcm﹣3 , 其晶胞结构如图所示.
该晶体的类型为 , Ga与As以键键合.Ga和As的摩尔质量分别为MGa gmol﹣1和MAs gmol﹣1 , 原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4﹣环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出): 
(1)写出反应④、⑦的化学方程式:④;
⑦ .
(2)②的反应类型是 , 上述七个反应中属于加成反应的有(填反应序号).
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾).可用下列装置制备. 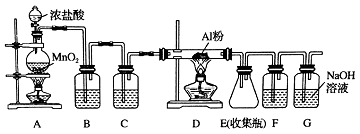
(1)装置B中盛放溶液,其作用是 . F中的是溶液,其作用是 . 用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 . 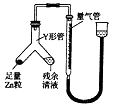
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是(填序号).
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如右图所示(夹持器具已略去).
①使Y形管中的残余清液与锌粒反应的正确操作是将转移到中.
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是(排除仪器和实验操作的影响因素).
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以1,3﹣丁二烯,丙烯,乙炔等为原料合成 ![]() 流程图如图
流程图如图 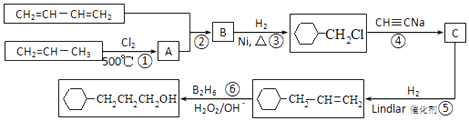
(1)反应①的反应类型是 , B中含有的官能团的名称 .
(2)写出反应②的化学方程式 .
(3)写出C的结构简式 .
(4)写出 ![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
(5)根据以上合成信息,以乙烯为原料合成1,6﹣己二醇,其他试剂任选,写出合成的流程图 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金用途广泛,如新型储氢合金材料的研究和开发,将为氢气作为能源的实际应用起到重要的推动作用.下列材料中,不属于合金的是( )
A.青铜
B.黄铜
C.陶瓷
D.不锈钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐的叙述中,正确的是 ( )
①硅酸盐大多都难溶于水 ②硅酸盐是构成地壳岩石的最主要成分
③硅酸盐中最常见的是Na2SiO3,它的水溶液俗称水玻璃
A. ③ B. ②③ C. ①② D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘(ICl)的化学性质跟Cl2相似,预计它与H2O反应的最初生成物是
A.HI和HClOB.HCl和HIOC.HClO3和HIOD.HCl和HI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com