
115°C时,两种气态烃以任意比例混合,1 L混合烃再与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃不符合此条件的是
A.CH4和C2H4 B.CH4和C3H4 C.C2H4和C3H4 D.C2H2和C3H6
科目:高中化学 来源: 题型:
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如右图所示。下列判断不正确的是
A.该实验方案的缺陷之一是未做空白对照实验
B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为
0.1 mmol·L-l
C.Fe3+不能提高乙酸降解速率
D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的
 降解速率依次减小
降解速率依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是

A.在第③、④、⑤步骤中,溴元素均被氧化
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.制取NaHCO3的反应是利用其溶解度小于NaCl
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
(化学——选修有机化学基础)(15分)
研究表明,火灾中,真正烧死的人其实并不多,大多数人都是因慌乱奔跑时吸入大量浓烟,导致烟雾中毒而死的。且起火的建筑装修越豪华,这一点越明显。聚氯乙烯(PVC)是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

请回答下列问题:
⑴火灾中由聚氯乙烯产生的有害气体,其化学成分主要是 ,你认为其中含量最大的为 ,①~③的反应类型是 。
在火灾现场,为防止气体中毒的防护措施是 。
⑵工业上用乙烯和氯气为原料经下列各步合成PVC:
 |  |  |
乙烯 甲 乙 PVC
乙是PVC的单体,其结构简式为 ,反应①、②的化学方程式分别为 、 。
⑶聚氯乙烯可以制成保鲜膜,化学工作者十分关注聚氯乙烯保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标
准的增塑剂DEHA。 邻苯二甲酸辛酯(DOP)是国家标准中允许使用的
邻苯二甲酸辛酯(DOP)是国家标准中允许使用的
增塑剂之一,邻苯二甲酸酐( )是制造DOP的原料,它跟过
量的甲醇反应能得到另一种增塑剂DMP
(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组说法均不正确的是
①CH3-CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③正戊烷、异戊烷、新戊烷的沸点逐渐变低
④丁二烯和丁烯为同系物
⑤标准状况下,11.2L的戊烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法
A.①②⑥ B.②③④ C.②③⑥ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)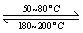 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+ O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ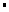 mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时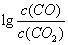 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
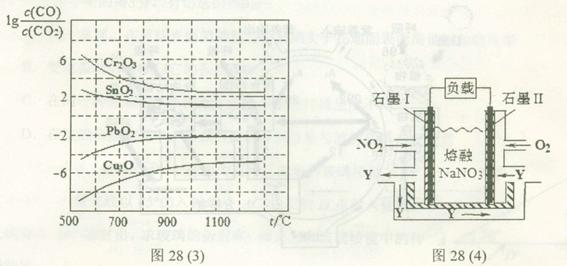
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮可以形成多种离子,如N3-、NH2 -、NH2、N3、NH4+、N2H5+、N2H62+等。
(1) 1998年美国化学家合成并表征了一种含有N5n+的盐类,该阳离子可看做是200多年来第三次以可分离量获得的全氮物种。第一次是在1772年分离出N2,第二次是1890年合成了叠氮酸根N3-,第三次就是合成N5n+。
① 写出与N3-互为等电子体的一种常见的分子 。
② 据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种阳离子“N5n+”,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N三N键。推测n=___ 。
③ 请预计科学家即将合成的N8属于 (填“单质”、“共价化合物”或“离子化合物”);请写出其含有的所有化学键的类型: ;预计它在常温下是___ 体(填固、液、气),熔沸点 (填“低”、“较高”或“高”)。
(2)2001年,专家从德国一家化肥厂生产出的硫酸铵中检出一种组成为N4H4(SO4)2的物质。经测定,该物质易溶于水,在水溶液中以SO42-和N4H44+两种空间构型均为正四面体的离子存在。N4H44+离子极易被植物的根系吸收,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。已知SO42-的结构式为 : 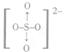 ,NH4+的结构式为 :
,NH4+的结构式为 : 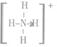 它们均是以S、N原子为中心的正四面体。回答问题:
它们均是以S、N原子为中心的正四面体。回答问题:
①预测N4H44+离子中四个氢原子围成的空间构型为
②N原子与氢原子之间的化学键为 (填“共价键”或“配位键”) ,N氮原子的杂化方式为 。
③科学家用另外的方法合成了一种以分子形式存在的N8分子,其晶胞为立方结构,分子中只有一种键长和键角,试画出其空间结构 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com