
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
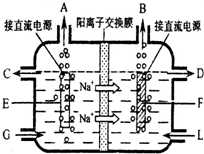 四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.2- 4 |
| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
2- 4 |
| ||
| ||
| ||
ρV1-
|
| ||
ρV1-
|
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第18期 总第174期 人教课标版(选修4) 题型:022
用如图所示的装置电解饱和食盐水时,可得到家用消毒液.烧杯中的搅拌子在搅拌器的作用下可以不断地旋转搅拌溶液,使其充分混合.当用石墨棒为阳极,铁棒为阴极进行电解时:
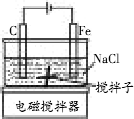
(1)开动搅拌器前的电解反应的离子方程式为________;若共收集标准状况下的气体22.4 L,则另一种产品的物质的量为________mol.
(2)开动搅拌器后,阴极的电极反应式是________,阳极的电极反应式是________,电解反应的离子方程式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com