
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
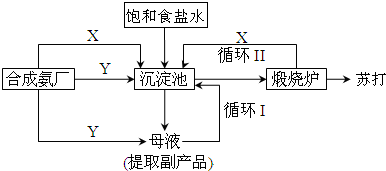
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| B. | 向BaCl2溶液中加入AgNO3和KI,当两种沉淀共存时,$\frac{c({I}^{-})}{c(C{l}^{-})}$=5.6×10-7 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | AgCl不溶于水,不能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol
某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

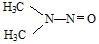 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2的电子式: | B. | Cl原子的结构示意图: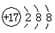 | ||
| C. | HClO分子的结构式:H-Cl-O | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/(L•s) | B. | 0.012 5 mol/(L•s) | C. | 0.05 mol/(L•s) | D. | 0.1 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com