
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
|
编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
|
浓度/ mol•L-1 |
体积/mL |
浓度/ mol•L-1 |
体积/mL |
||
|
① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
|
② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
|
③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ mol•L-1•min-1。
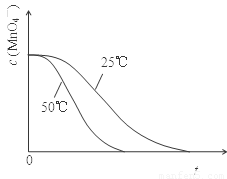
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。

(16分)(1)2 2.5(每空3分)
(2)②和③ ①和②(每空2分)
(3)0.010或1.0 ×10-2(3分,0.01得2分)
(4)如图(3分。标注1分,正确做图2分)
【解析】
试题分析:(1)草酸中碳元素为+3价,二氧化碳中碳元素为+4价,由化合价升高总数等于转移电子数可知1个H2C2O4转移2个电子,则每消耗1molH2C2O4转移2mol 电子;草酸与酸性高锰酸钾溶液反应为5H2C2O4+2KMnO4+3H2SO4=10CO2↑+K2SO4+2MnSO4+8H2O~10e-,只有当KMnO4完全反应,溶液的紫红色才能褪去,如果n(H2C2O4)=5mol、n(KMnO4)≤2mol,就能观察到紫色褪去,所以c(H2C2O4)∶c(KMnO4) = n(H2C2O4)∶n(KMnO4)≥2.5;(2)根据控制变量设计探究实验方案原则,实验②和③所用试剂的浓度、体积均相同,反应温度分别为25℃、50℃,这组对比实验的目的是探究温度对化学反应速率的影响;实验①和②的温度相同,酸性高锰酸钾溶液的浓度、体积均相同,草酸浓度分别为0.1mol/L、0.2mol/L,这组实验的目的是探究浓度对化学反应速率的影响;实验①和③既改变了反应物的浓度,又改变了反应温度,不能得到合理的结论;(3)实验①中:2.0mL草酸溶液加入4.0mL酸性高锰酸钾溶液,能稀释后者,设稀释后高锰酸钾的初始浓度为xmol/L,根据题意和稀释定律(c1•V1=c2•V2)可知,0.010 mol•L-1×4.0×10-3L=x mol•L-1×(4.0+2.0)×10-3L,则x=0.010 mol•L-1×4.0/6.0,紫色恰好褪色时高锰酸钾浓度减小为0,则△c(KMnO4) =0.010 mol•L-1×4.0/6.0,而△t=40/60min,由v=△c/△t可得,v(KMnO4)=△c(KMnO4)/△t=0.010 mol•L-1×4.0/6.0÷40/60min=0.010 mol•L-1•min-1;(4)根据控制变量原则,高锰酸根离子的起始浓度不变,仅仅降低温度,反应速率减小,则褪色的时间增大,相同时间内高锰酸根离子的变化浓度减小,则25℃时反应过程中c(MnO4-)~t的变化曲线位于50℃时曲线的右边。
考点:考查氧化还原反应、浓度和温度对化学反应速率的影响、稀释定律、物质的量浓度和平均反应速率的计算、画出不同温度对反应物浓度与反应时间的变化示意图等。


科目:高中化学 来源: 题型:

| ||
| ||

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.
(2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
|
实验编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度 |
||
|
浓度(mol·L-1) |
体积(mL) |
浓度(mol·L-1) |
体积 (mL) |
||
|
① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
|
② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
|
③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
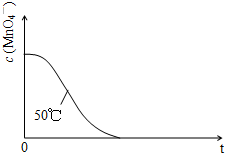
(4)已知实验③中c(MnO4-)~反应时间t的变化曲线如下图。若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省温州市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
I.煤化工中常需研究不同溫度下平衡常数、投料比等问题。
已知:CO (g) +H2O(g) H2 (g) +CO2
(g)平衡常数K随温度的变化如下表:
H2 (g) +CO2
(g)平衡常数K随温度的变化如下表:

回答下列问题
(1)该反应的平衡常数表达式K=______,ΔH=______0(填“<”、“>”、“=”)
(2)已知在一定温度下,CCs) +CO2 (g) 2C0
Cg)平衡常数K1;
2C0
Cg)平衡常数K1;
C (s)
+H2O (g) CO
Cg) +H2 (g)平衡常数K2
CO
Cg) +H2 (g)平衡常数K2
则K、K1 、K2,之间的关系是______:
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为:若保持其他条件不变,向平衡体系中 再通入0.10molCO和0.40molCO2,此时v正 ______v逆 (填“>”、“=”或“<”)。
II.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。
(4) 向酸性KmnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KmnO4耗尽后,紫色溶 液将褪去。为确保能观察到紫色褪去,H2C2O4与KmnO4初始的物质的量需要满足的关 系为n(H2C2O4): n(KMnO4) ______。
(5) 为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案

表中x= ______ ml ,理由是______。
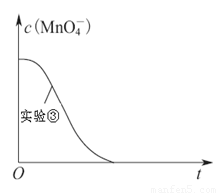
(6) 已知50°C时,浓度c(H2C2O4)随反应时间t的变化曲线如图示,若保持其他条件不变,请在答题卡坐标图 中画出25°C时c(H2C2O4)随t的变化曲线示意图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com