
| A. | 2一甲基丁烷 | B. | 2一甲基丙烷 | C. | 2,2一二甲基丙烷 | D. | 2一乙基丙烷 |
分析 烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
解答 解:A、2-甲基丁烷,符合烷烃命名原则,故A正确;
B、2-甲基丙烷,符合烷烃的命名原则,故B正确;
C、2,2-二甲基丙烷,符合烷烃的命名原则,故C正确;
D、2-乙基丁烷,2号碳上出现乙基,说明选取的不是最长碳链,正确命名为:2-甲基丁烷,故D错误,故选D.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属间在溶液中发生置换反应 | |
| B. | 1 mol金属单质在反应中失去电子的多少 | |
| C. | 金属元素的最高价氧化物的水化物的碱性强弱 | |
| D. | 金属单质与水或酸置换出氢气的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌电极为电流流出 | B. | 锌电极为正极 | ||
| C. | 锌电极有气泡 | D. | 反应中Zn被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据能量守恒有Q1+Q2=2Q3 | |
| B. | 该反应中的能量变化为 ︳Q1+Q2-2Q3︳ | |
| C. | 若Q1+Q2>2Q3,则反应为放热反应 | |
| D. | 若1molA2和1molB2的总能量之和小于2molAB的总能量,则反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
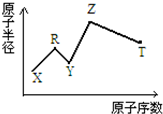 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s23p64s2 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p63s23p2 | D. | 1s22s22p4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com