
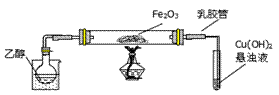
 某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.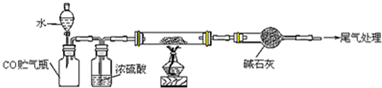
| x |
| y |
| a-b |
| 56 |
| b |
| 16 |
| 2(a-b) |
| 7b |
| 2(a-b) |
| 7b |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、2molNa被完全氧化生成1mol Na2O2,得到2NA个电子 |
| B、在1L0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
| D、在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol I2,则转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极上析出5.6mL O2(标准状况) |
| B、阴极上析出64mg Cu |
| C、阴极上析出11.2mL H2(标准状况) |
| D、阳极和阴极质量都无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
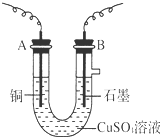 某化学兴趣小组用电解CuSO4溶液的方法,测定铜的相对原子质量.(装置如图所示)
某化学兴趣小组用电解CuSO4溶液的方法,测定铜的相对原子质量.(装置如图所示)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解的实质是:阳极:2Cl--2e-=Cl2↑;阴极:Ag+e-=Ag |
| B、电解的实质是:阳极:4OH--4e-=2H2O+O2↑;阴极:2H++2e-=H2↑ |
| C、要恢复成电解前的溶液可以加水 |
| D、电解产物中氧化产物和还原产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
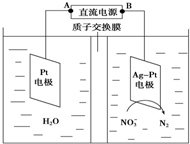 目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3- 或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )
目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3- 或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )| A、Pt电极为阴极 |
| B、电解过程中H+向正极移动 |
| C、理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为2:5 |
| D、电解过程中Pt电极附近溶液的pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com