以含有Al
2O
3、Fe
2O
3等杂质的铬铁矿[主要成份为Fe(CrO
2)
2]为主要原料生产重铬酸钠晶体(Na
2Cr
2O
7?
2H
2O)的主要工艺流程如下:
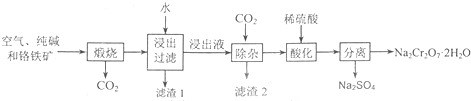
己知:铬铁矿在空气中与纯碱煅烧生成Na
2CrO
4和一种红棕色固体,同时释放出CO
2气体,同时Al
2O
3+Na
2CO
3 2NaAlO
2+CO
2↑.请回答:
(1)在铬铁矿Fe(CrO
2)
2中,Cr的化合价为
.
(2)滤渣1的成分为
,滤渣2的成分为
.
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是
.
(4)铬铁矿中的Al
2O
3杂质在工业上可用来冶炼铝,该化学方程式为
.
(5)根据有关国家标准,含CrO
42-的废水要经化学处理,使其浓度降至5.0×10
-7mol/L以下才能排放.含
CrO
42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO
4沉淀[K
SP(BaCrO
4)=1.2×10
-10],再加入可溶性硫酸盐处理多余的
Ba
2+.加入可溶性钡盐后的废水中Ba
2+的浓度应不小于
mol/L,后续废水处理方能达到国家排放标准.
②还原法:CrO
42-Cr
Cr(OH)
3.写出酸性条件下CrO
42-与绿矾在溶液中反应的离子方程式
.
(6)某高效净水剂是由K
2FeO
4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K
2FeO
4,该反应的化学方程式是
.




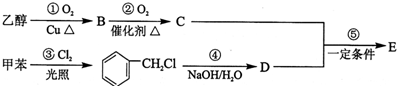
 的△H为-384 kJ?mol-1
的△H为-384 kJ?mol-1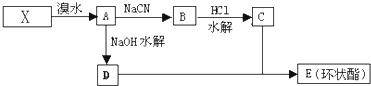
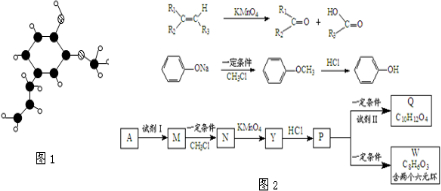
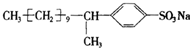 ,其结构中与肥皂(C17H35COONa)的憎水基团-C17H35相当的基团为
,其结构中与肥皂(C17H35COONa)的憎水基团-C17H35相当的基团为