
| 步骤 | 实验操作 | 实验现象 |
| Ⅰ | 向X的粉末中加入过量盐酸 | 产生气体A,得到无色溶液 |
| Ⅱ | 向Ⅰ所得的溶液中滴加氨水,调节pH至5~6,过滤 | 生成白色沉淀B |
| Ⅲ | 向沉淀B中加过量NaOH溶液 | 沉淀全部溶解 |
| Ⅳ | 向Ⅱ得到的滤液中滴加NaOH溶液,调节pH至12 | 生成白色沉淀C |


科目:高中化学 来源: 题型:
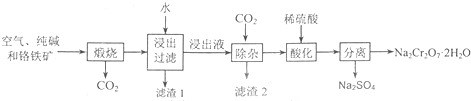
| ||
. |
| 绿矾 |
| H+ |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Q | I1 | I2 | I3 | I4 | I5… |
| 电离能 (Kj/mol) | 496 | 4562 | 6912 | 9543 | 13353 … |
查看答案和解析>>
科目:高中化学 来源: 题型:
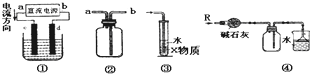
| A、装置①中,c为阳极,d为阴极 |
| B、装置②可用于收集H2、NH3、Cl2、HCl、NO2等 |
| C、装置③中X为苯,可用于吸收氨气或氯化氢 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、③⑤ |
| C、③④⑤⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 88.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
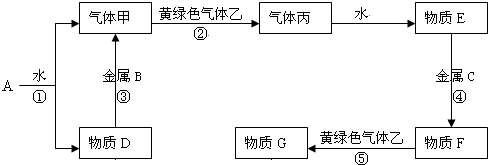
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com