
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: 
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 , 反应④的化学方程式为 .
(2)若A是常见的变价金属的单质,D、F是气态单质,反应④可以在光照条件下发生.反应①和反应②在水溶液中进行,反应②的离子方程式是
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 . 标准状况下3.36L物质E与含氢氧化钠10.0g的溶液充分反应,所得溶液中溶质成分为(写出化学式和对应的物质的量).
【答案】
(1) ;C+4HNO3(浓)
;C+4HNO3(浓) ![]() CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
(2)Cl2+2Fe2+=2Cl﹣+2Fe3+
(3)2C+SiO2 ![]() Si+2CO↑;Na2CO2 , 0.1mol;NaHCO3 , 0.05mol
Si+2CO↑;Na2CO2 , 0.1mol;NaHCO3 , 0.05mol
【解析】解:(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,则A原子序数是偶数,所含元素的原子最外层电子数D是A的2倍,则A是Mg、D是C元素,F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体是NO2 , 则F是HNO3 , C和HNO3浓溶液反应生成CO2、NO2和H2O,B能和Mg反应生成碳单质,则B是CO2 , C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2 , 则E是Mg(NO3)2 , A是Mg,A的原子结构示意图为 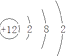 ,反应④的化学方程式为在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓)
,反应④的化学方程式为在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓) ![]() CO2+4NO2↑+2H2O,
CO2+4NO2↑+2H2O,
所以答案是:  ;C+4HNO3(浓)
;C+4HNO3(浓) ![]() CO2+4NO2↑+2H2O;(2)若A是常见的变价金属的单质,则A是Fe,D、F是气态单质,反应①在水溶液中进行.反应②也在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2 , 氯化亚铁被氯气氧化生成氯化铁,离子反应方程式为:Cl2+2Fe2+=2Cl﹣+2Fe3+ ,
CO2+4NO2↑+2H2O;(2)若A是常见的变价金属的单质,则A是Fe,D、F是气态单质,反应①在水溶液中进行.反应②也在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2 , 氯化亚铁被氯气氧化生成氯化铁,离子反应方程式为:Cl2+2Fe2+=2Cl﹣+2Fe3+ ,
所以答案是:Cl2+2Fe2+=2Cl﹣+2Fe3+;(3)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,则B为SiO2 , A、F所含元素同周期,则A为C,D为Si,F为O2 , 根据转化关系,C为CO,E为CO2 , 反应①为C与二氧化硅的反应,该反应为2C+SiO2 ![]() Si+2CO↑,
Si+2CO↑,
将标准状况下3.36L二氧化碳为 ![]() =0.15mol,10.0g 氢氧化钠为
=0.15mol,10.0g 氢氧化钠为 ![]() =0.25mol,二者物质的量之比为3:5,介于2:1与1:1之间,则生成Na2CO3、NaHCO3 , 设二者物质的量分别为xmol、ymol,则
=0.25mol,二者物质的量之比为3:5,介于2:1与1:1之间,则生成Na2CO3、NaHCO3 , 设二者物质的量分别为xmol、ymol,则 ![]() ,解得x=0.1,y=0.05,
,解得x=0.1,y=0.05,
所以答案是:2C+SiO2 ![]() Si+2CO↑;Na2CO2 , 0.1mol;NaHCO3 , 0.05mol.
Si+2CO↑;Na2CO2 , 0.1mol;NaHCO3 , 0.05mol.


科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水的综合利用具有重要意义(如下图)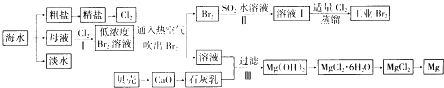
(1)氯碱工业主要以食盐为原料,为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作:①加过量的NaOH溶液;②加过量的BaCl2溶液③加过量的Na2CO3溶液;④过滤;⑤加适量的盐酸,第③步操作的目的是
(2)在实验室可以用萃取的方法提取溴,在萃取操作过程中,下列说法不正确的是 .
A.萃取剂可选用苯、CCl4、裂化汽油等有机溶剂.
B.萃取分液时下层液体从下口放出,上层液体从上口倒出
C.在萃取过程中,需要振荡分液漏斗,并打开分液漏斗上口的玻璃塞放气.
(3)通入热空气吹出溴,并用SO2的水溶液吸收的目的是 .
(4)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 .
(5)步骤Ⅲ中有关反应的离子方程式 , 解释该反应能够发生的原因 .
(6)海水提溴蒸馏过程中,温度应控制在80﹣90℃,温度过高或过低都不利于生产,请解释原因 .
(7)工业上不用电解熔融MgO制金属镁,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化在给定条件下不能实现的是( )
A.Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
B.S ![]() SO3
SO3 ![]() H2SO4
H2SO4
C.饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
D.MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如右图所示.则下列说法正确的是( ) 
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO32﹣ , 一定含有SO42﹣和NO3﹣
C.溶液中n(NH4+)=0.2 mol
D.三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分子式为C10H14的有机物,该有机物不能与溴水发生加成反应,分子中只有一个烷基,符合要求的有机物结构有( )
A.2种
B.3种
C.4种
D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2g铜与足量浓硫酸混合加热,使其充分反应.
(1)该反应的化学方程式是 .
(2)反应后生成的气体在标准状况下的体积为L.
(3)将反应后溶液加水稀释至50mL,所得溶液中Cu2+的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用明矾石(主要成分:K2SO4Al2(SO4)32Al2O36H2O,少量杂质Fe2O3)制备氢氧化铝的流程如图所示:
(1)焙烧炉中反应为:2Al2(SO4)3+3S═2Al2O3+9SO2; 该反应的氧化剂及被氧化的元素分别是:;若生成1mol Al2O3 , 则转移电子数是个;
(2)熟料溶解时的离子方程式: .
(3)检验废渣中含有Fe2O3所需的试剂: . 所观察到的现象为
(4)母液中溶质的主要成分的化学式为:;溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀洗涤干净的实验操作和现象是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com