
| A. | 工业上电解熔融的氯化钠可以制备钠 | |
| B. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| C. | 工业上电解饱和氯化镁溶液可制取金属镁 | |
| D. | 工业上常用H2在Cl2中燃烧生成的氯化氢溶于水来制取盐酸 |
分析 A、电解熔融氯化钠的方法制取钠;
B、Cl2和石灰乳反应氯化钙和次氯酸钙;
C、电解氯化镁溶液得到氢氧化镁、氢气和氯气;
D、工业生产盐酸是氢气在氯气中燃烧生成氯化氢,然后将氯化氢溶于水.
解答 解:A、钠是活泼金属,工业上采用电解熔融氯化钠的方法制取钠,故A正确;
B、Cl2和石灰乳反应氯化钙和次氯酸钙,所以工业上用Cl2和石灰乳为原料制造漂白粉,故B正确;
C、电解熔融的氯化镁可以来制取金属镁,故C错误;
D、氢气在氯气中燃烧,然后将生成的氯化氢气体溶于水,得到氯化氢的水溶液即是盐酸,这也是工业制盐酸的生产方式,故D正确;
故选C.
点评 本题考查漂白粉、盐酸的工业制法和氯碱工业,以及电解池的工作原理的应用等知识,综合性强,但比较容易.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
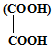
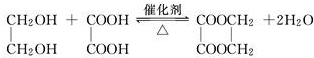 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | W克该原子的物质的量一定是$\frac{W}{a{N}_{A}}$ mol | |
| C. | W克该原子中含有$\frac{W}{b}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠溶液和过量的Ba(OH)2溶液反应SO42-+H++Ba2++OH-=BaSO4↓+H2O | |
| B. | 碳酸氢钠水解:HCO3-+H2O=CO32-+H3O+ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 用铂电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式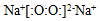 | |
| B. | CO2的电子式: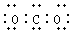 | |
| C. | ${\;}_{53}^{127}$I和${\;}_{53}^{129}$I2互为同位素 | |
| D. | 硫离子的结构示意图: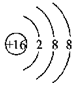 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
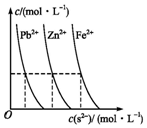 平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.
平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取5.2 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液中所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com