
 X、Y、Z、W、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于第二周期且相邻,W是非金属元素,其中基态Y原子的2p轨道处于半充满状态,基态W原子的3p能级上有一个未成对电子.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、W、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于第二周期且相邻,W是非金属元素,其中基态Y原子的2p轨道处于半充满状态,基态W原子的3p能级上有一个未成对电子.含U的化合物的焰色为紫色.试回答下列问题: .
.分析 X、Y、Z、U为原子序数依次增大的前四周期元素,基态Y原子的2p轨道处于半充满状态,则外围排布为2s22p3,则Y为氮元素,X、Y、Z三种元素位于第二周期且相邻,可知X为C元素,Z为O元素,基态W原子的3p能级上有一个未成对电子,且W为非金属,应为Cl元素,含U的化合物的焰色为紫色,则U为钾元素,以此解答该题.
解答 解:X、Y、Z、U为原子序数依次增大的前四周期元素,基态Y原子的2p轨道处于半充满状态,则外围排布为2s22p3,则Y为氮元素,X、Y、Z三种元素位于第二周期且相邻,可知X为C元素,Z为O元素,基态W原子的3p能级上有一个未成对电子,且W为非金属,应为Cl元素,含U的化合物的焰色为紫色,则U为钾元素,
(1)Y为N元素,对应的简单氢化物分子式为NH3,W为Cl,对应的价电子排布图为 ,故答案为:NH3;
,故答案为:NH3; ;
;
(2)X为碳元素,一种氢化物的相对分子质量为28,该氢化物为C2H4,分子中含有1个C=C双键、4个C-H,C=C双键含有1个σ键、1个π键,单键为σ键,故C2H4分子中σ键与π键的键数之比为5:1
故答案为:5:1;
(3)向硫酸铜溶液中逐滴滴入氨水溶液至过量,先生成氢氧化铜与硫酸铵,有蓝色沉淀生成,继续滴加过量的氨水,氢氧化铜与氨水反应生成四氨合铜络离子,蓝色沉淀消失,溶液呈深蓝色,反应离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)①A.由图可知晶胞中K原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O原子数目为4×2×$\frac{1}{4}$+8×$\frac{1}{2}$+8×$\frac{1}{4}$=8,每个晶胞中含有4个K+和4O2-,故A错误;
B.由晶胞结构可知,晶体中每个K+周围距离K+最近的O2-有6个,故B正确;
C.该晶体由K+和O2-构成,属于离子晶体,故C正确;
D.化合物甲由Z、U两元素组成,其晶胞如右图所示. 由晶胞结构可知,晶胞中K原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O原子数目为4×2×$\frac{1}{4}$+8×$\frac{1}{2}$+8×$\frac{1}{4}$=8,故K原子与O原子数目之比为4:8=1:2,故甲的化学式为KO2,故D错误.
由晶胞结构可知,晶胞中K原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O原子数目为4×2×$\frac{1}{4}$+8×$\frac{1}{2}$+8×$\frac{1}{4}$=8,故K原子与O原子数目之比为4:8=1:2,故甲的化学式为KO2,故D错误.
故答案为:BC;
②晶胞的质量为$\frac{4×71}{{N}_{A}}$g,甲的密度为a g•cm-3,则晶胞的体积是$\frac{\frac{4×71}{{N}_{A}}g}{ag/c{m}^{3}}$=$\frac{284}{a{N}_{A}}$cm3,
故答案为:$\frac{284}{a{N}_{A}}$.
点评 本题考查结构性质位置关系、化学键、晶胞结构与计算等,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,推断元素是解题关键,注意利用均摊法进行晶胞的计算.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质 | B. | 氧化物 | C. | 无机物 | D. | 有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能有一种分类标准 | B. | 分类标准不同,物质所属类别不同 | ||
| C. | 可能有多种分类标准 | D. | 一种分类标准对应一种分类结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(HCl):用饱和NaHCO3溶液 | B. | CO2(SO2):用饱和KMnO4溶液 | ||
| C. | Cl2(HCl):用饱和NaCl溶液 | D. | SO2(HCl):用饱和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
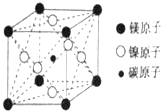 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 | |
| B. | 氯气是塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料 | |
| C. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| D. | 用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com