

A.吸收池中反应的化学方程式为:K2CO3+CO2+H2O=2KHCO3
B.在合成塔中,若有4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则该反应的热化学方程 式是:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.47 kJ/mol
C.分解池溶液中存在的电离有:KHCO3=K++HCO3-,HCO3-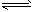 H++CO32-,H2O
H++CO32-,H2O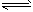 H++OH-,
H++OH-,
HCO3-+H2O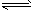 H2CO3+OH-
H2CO3+OH-
D.以甲醇为原料的新型燃料电池得到了广泛运用,该电池放电一段时间后,通入O2的电极附近溶液的
pH 升高
科目:高中化学 来源: 题型:阅读理解
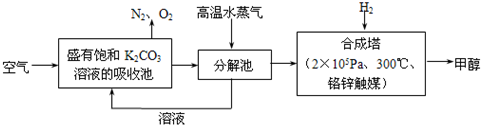
 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.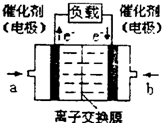
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:

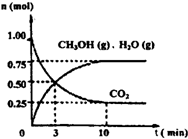
| ||
| ||
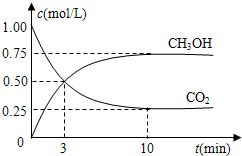
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com