
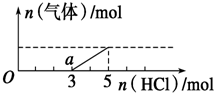
 ��һ������CO2����ͨ��2Lδ֪Ũ�ȵ�NaOH��Һ�У���������Һ����μ���ϡ������������������Һ���ȣ�������������HCl�����ʵ����Ĺ�ϵ��ͼ��ʾ������������ܽ��HCl�Ļӷ���������˵������ȷ���ǣ�������
��һ������CO2����ͨ��2Lδ֪Ũ�ȵ�NaOH��Һ�У���������Һ����μ���ϡ������������������Һ���ȣ�������������HCl�����ʵ����Ĺ�ϵ��ͼ��ʾ������������ܽ��HCl�Ļӷ���������˵������ȷ���ǣ�������| A�� | O����Һ���������ʵĻ�ѧʽΪNaOH��Na2CO3 | |
| B�� | �����£�a����ҺpH��7 | |
| C�� | ��״���£�ͨ��CO2�����Ϊ4.48L | |
| D�� | ԭNaOH��Һ�����ʵ���Ũ��Ϊ2.5mol/L |
���� A��Na2CO3������ķ�Ӧ�Ƿֲ����еģ�Na2CO3+HCl=NaHCO3+NaCl��NaHCO3+HCl=NaCl+H2O+CO2������ͼ���֪���ɶ�����̼���ĵ�HCl�����ʵ���С�ڴӷ�Ӧ����ʼ����������̼�����ĵ�HCl������Һ������ΪNaOH��Na2CO3��
B��a����Һ������Ϊ̼�����ƣ�
C����ͼ��֪��a��ʱ��ʼ�������壬�ʷ�����ӦΪ��NaHCO3+HCl=NaCl+H2O+CO2���������ɶ�����̼������ʱ���ý����ĵ�HCl�����ʵ���Ϊ2mol���ݴ˸��ݷ���ʽ�������ɵĶ�����̼�����ʵ��������ɵĶ�����̼�����ʵ������ڿ�ʼͨ��Ķ�����̼�����ʵ���������V=nVm���������̼�������
D�����ɶ�����̼������ʱ����ʱ��Һ������ΪNaCl�������������غ���n��NaCl��=n��HCl�����ٸ����������غ���n��NaOH��=n��NaCl��������c=$\frac{n}{V}$����NaOH��Һ�����ʵ���Ũ�ȣ�
��� �⣺A��Na2CO3������ķ�Ӧ�Ƿֲ����еģ�Na2CO3+HCl=NaHCO3+NaCl��NaHCO3+HCl=NaCl+H2O+CO2����HCl��Na2CO3��NaHCO3����1��1��Ӧ����ͼ���֪���ɶ�����̼���ĵ�HCl�����ʵ���С�ڴӷ�Ӧ����ʼ����������̼�����ĵ�HCl������Һ������ΪNaOH��Na2CO3����A��ȷ��
B��a����Һ������Ϊ̼�����ƣ�̼��������Һ�Լ��ԣ�����ҺpH��7����B��ȷ��
C����ͼ��֪��a��ʱ��ʼ�������壬�ʷ�����ӦΪ��NaHCO3+HCl=NaCl+H2O+CO2���������ɶ�����̼������ʱ���ý����ĵ�HCl�����ʵ���Ϊ2mol���ɷ���ʽ��֪����������̼�����ʵ���Ϊ2mol�����ɵĶ�����̼�����ʵ������ڿ�ʼͨ��Ķ�����̼�����ʵ������ʿ�ʼͨ��Ķ�����̼�����Ϊ2mol��22.4L/mol=44.8L����C����
D������5molHCl���ɶ�����̼������ʱ��Һ������ΪNaCl�������������غ���n��NaCl��=n��HCl���������������غ���n��NaOH��=n��NaCl������n��NaOH��=n��HCl��=5mL������c��NaOH��=$\frac{5mol}{2L}$=2.5mol/L����D��ȷ��
��ѡC��
���� ���⿼������ļ��㣬��Ŀ�Ѷ��еȣ�ע���ͼ�������Ӧ������������ؼ��Ǹ���ͼ���ж���Һ���ʵijɷ֣�


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�����Ҵ����������Ȼ�̼ | |
| B�� | �ñ����������Һ�ɷ�����ۺ͵����ʵĻ����Һ | |
| C�� | ��̼������Һ�ɼ����Ҵ���������������� | |
| D�� | �����Ը��������Һ���𱽡�ֲ���ͺ��ѻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molCl2�μӻ�ѧ��Ӧ��õĵ���������2NA | |
| B�� | 6.4 gO2��O3�Ļ����������Oԭ����һ��Ϊ0.4NA | |
| C�� | ��4nmol HCl��Ũ������������MnO2���ȷ�Ӧ�����ɵ�Cl2������ΪnNA | |
| D�� | 1molij��������Ϊ22.4L���������״��һ���DZ�״�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{8}^{16}$O��${\;}_{8}^{18}$OΪ��ͬ�ĺ��أ��в�ͬ�Ļ�ѧ���� | |
| B�� | H2��SO2��NH3�������嶼����Ũ������� | |
| C�� | ��ɢϵ�з�ɢ�����ӵ�ֱ����Fe��OH��3����Һ��Fe��OH��3���壾FeCl3��Һ | |
| D�� | �մɡ�������ˮ�ࡢ����ʯ����Ҫ�ɷֶ��ǹ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
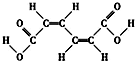
| A�� | ������������3�ֲ�ͬ��ѧ�������⣨������˳���칹�� | |
| B�� | 1mol���л�����Ժ�2mol NaOH��Ӧ����������Na2CO3��Һ���ָ��л����CH3COOCH2CH3 | |
| C�� | ���л����ܷ����ӳɷ�Ӧ���ܷ���ȡ����Ӧ | |
| D�� | ���л��������ụΪͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaͶ�뵽�����������У�2Na+2H2O�T2Na++2OH-+H2�� | |
| B�� | AlCl3��Һ�м��������İ�ˮ��Al3++4OH-�TAlO2-+2H2O | |
| C�� | ���Ȼ�����Һ�м���ͭ�ۣ�Fe3++Cu�TFe2++Cu2 | |
| D�� | ������ͨ���������������Һ�У�Cl2+2OH-�TCl-+ClO-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
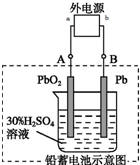 Ǧ�����ǵ��͵Ŀɳ���أ���ص��������Ϸֱ���Pb��PbO2�������H2SO4����ش��������⣮
Ǧ�����ǵ��͵Ŀɳ���أ���ص��������Ϸֱ���Pb��PbO2�������H2SO4����ش��������⣮�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com