
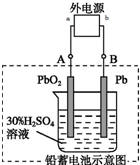
 铅蓄电池是典型的可充电电池,电池的两极材料分别是Pb、PbO2,电解质H2SO4.请回答下列问题.
铅蓄电池是典型的可充电电池,电池的两极材料分别是Pb、PbO2,电解质H2SO4.请回答下列问题.分析 (1)根据电池反应式知,放电时负极电极反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,根据电池反应式及电极反应式分析解答;
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,该装置是电解池,铅板电极为阴极,得电子发生还原反应,二氧化铅作阳极,失电子发生氧化反应;铅蓄电池中的电池反应式为PbO2+Pb+2H2SO4 =2PbSO4+2H2O,根据原电池和电解池中转移电子数相等计算消耗硫酸的物质的量.
解答 解:(1)放电时,铅作负极,二氧化铅作正极,正极上得电子发生还原反应,所以正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;
根据电池反应式知,原电池放电时,电解液中H2SO4参加反应,所以硫酸浓度将减少,pH变大,当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加0.5mol×303g/mol-0.5mol×207g/mol=48g;
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;变大;96;
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,该装置是电解池,铅板电极为阴极,得电子发生还原反应,二氧化铅作阳极,失电子发生氧化反应,
B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++SO42-,A电极发生反应为PbSO4=Pb-2e-+SO42-,a为正极,b为负极,所以B电极上生成PbO2,A极上生成Pb,
电解AgNO3溶液有2.16g析出时,解:n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,转移电子0.02mol,铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4↓+2H2O,当转移2mol电子时消耗硫酸为2mol,则转移电子为0.02mol时,消耗0.02molH2SO4,故答案为:正;PbSO4+2H2O-2e-=PbO2+4H++2SO42-;C.
点评 本题考查了铅蓄电池的工作原理和电极反应的书写,关键是原电池中的电极消耗完后电极上是硫酸铅,接通电源进行电解反应,注意把握原电池的总反应,为解答(2)题的关键.


科目:高中化学 来源: 题型:选择题
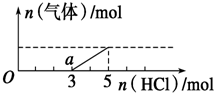 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 常温下,a点溶液pH>7 | |
| C. | 标准状况下,通入CO2的体积为4.48L | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1528.6 kJ/mol | B. | -1639.8 kJ/mol | C. | -1473 kJ/mol | D. | -1695.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 水解反应 | ||
| C. | 醋酸的电离 | D. | 盐酸与NaOH溶液的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 一个化学反应中,当反应物总能量大于反应产物总能量时,反应放热,△H>0 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
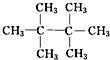
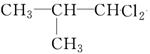 、
、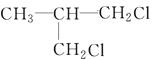 、
、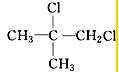 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
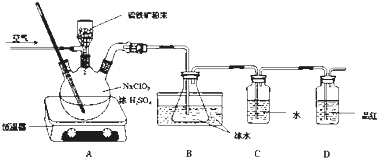
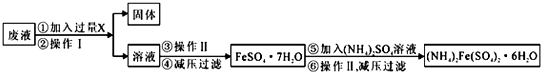
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com