
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
| | X | Y | W |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |

A
解析试题分析:根据表中数据可知,平衡时X、Y、Z的物质的量的变化量分别是1mol、0.5mol、1.5mol,所以该反应的方程式是2X+Y 3Z,则根据平衡常数的概念可知,D不正确;平衡时X、Y、Z的物质的量浓度分别是(mol/L)0.5、0.25、0.75,所以该温度下,此反应的平衡常数K=
3Z,则根据平衡常数的概念可知,D不正确;平衡时X、Y、Z的物质的量浓度分别是(mol/L)0.5、0.25、0.75,所以该温度下,此反应的平衡常数K= ,A正确;升高温度,若W的体积分数减小,说明升高温度平衡向逆反应方向移动,因此该反应ΔH<0,B不正确;正方应是体积不变的可逆反应,所以改变压强,平衡不移动,C不正确,答案选A。
,A正确;升高温度,若W的体积分数减小,说明升高温度平衡向逆反应方向移动,因此该反应ΔH<0,B不正确;正方应是体积不变的可逆反应,所以改变压强,平衡不移动,C不正确,答案选A。
考点:考查平衡常数的判断与计算、外界条件对平衡状态的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,难易适中,贴近高考。在注重对学生基础性知识巩固与训练的同时,侧重对学生学习方法的指导与训练,有利于调动学生的学习兴趣,激发学生的求知欲。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
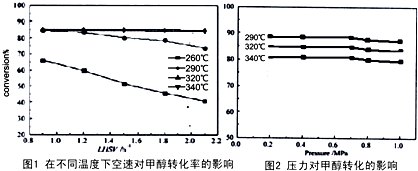
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
| ||||
|
| 32Cw |
| 32Cw+9CM) |
| ||||
|
| 32Cw |
| 32Cw+9CM) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间/S | c(CO2)mol/L | c(H2)mol/L |
| 0 | 1.00×10-1 | 3.00×10-1 |
| 1 | 8.50×10-2 | 2.55×10-1 |
| 2 | 6.50×10-2 | 1.95×10-1 |
| 3 | 5.50×10-2 | 1.65×10-1 |
| 4 | 5.00×10-2 | 1.50×10-1 |
| 5 | 5.00×10-2 | 1.50×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
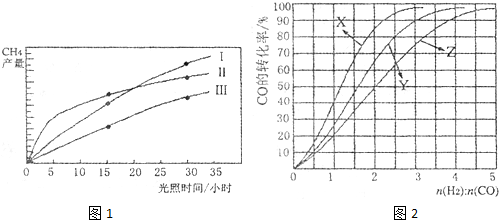
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com