
 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.| 2.33g |
| 233g/mol |


科目:高中化学 来源: 题型:
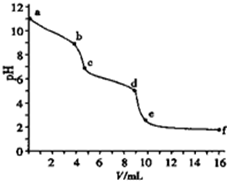
| A、以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3 |
| B、以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml |
| C、溶液pH=7(c点),碳酸钠完全转化为NaCl |
| D、ce段对应溶液中CO2与NaHCO3共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝土矿溶于NaOH溶液中 |
| B、NaAlO2溶液的酸化 |
| C、灼烧氢氧化铝固体 |
| D、电解熔融的氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 可以测量锌粒与硫酸的反应速率 |
B、 可以进行中和热的测定实验 |
C、 可验证温度对化学平衡的影响 |
D、 可研究催化剂对化学反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
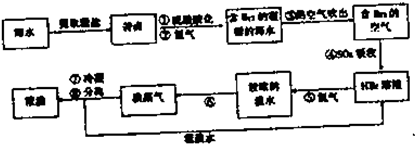
查看答案和解析>>
科目:高中化学 来源: 题型:
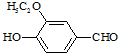 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.| CrO3/H2SO4 |
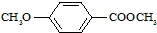 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( 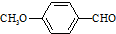 )合成X.用反应流程图表示如下:
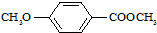
)合成X.用反应流程图表示如下: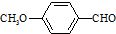 →
→
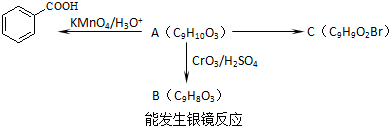
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3?H2O) |
| B、某溶液中只存在Cl-、OH、NH4+、H+四种离子,则一定不存在下列关系:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、将0.2 mol?L-1的某一元酸HA溶液和0.1 mol?L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,则溶液的pH一定为14-a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com