
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
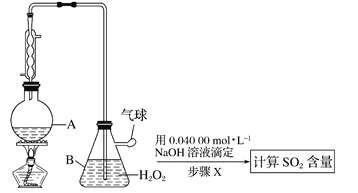
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
【答案】(12分)(除特别注明,均每空2分)
I.(1)SO2(g)![]() SO2 (aq);SO2+H2O
SO2 (aq);SO2+H2O![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H+ + HSO3-;HSO3-
H+ + HSO3-;HSO3-![]() H+ + SO32-
H+ + SO32-
(2)干白中二氧化硫或亚硫酸含量太少
II.(3)圆底烧瓶;
(4)SO2+H2O2===H2SO4;
(5)加入二氧化锰并振荡
(6)0.32;盐酸的挥发造成的干扰
【解析】试题分析: (1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在的平衡有:SO2(g)![]() SO2 (aq);SO2+H2O
SO2 (aq);SO2+H2O![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H+ + HSO3-;HSO3-
H+ + HSO3-;HSO3-![]() H+ + SO32-,故答案为:SO2(g)
H+ + SO32-,故答案为:SO2(g)![]() SO2 (aq);SO2+H2O
SO2 (aq);SO2+H2O![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H+ + HSO3-;HSO3-
H+ + HSO3-;HSO3-![]() H+ + SO32-;
H+ + SO32-;
(2)根据对比实验,干白葡萄酒中滴入品红溶液,红色不褪去,可能是葡萄酒中的二氧化硫的含量太少的缘故,故答案为:干白中二氧化硫或亚硫酸含量太少;
Ⅱ. (3)根据装置图,仪器A是圆底烧瓶,故答案为:圆底烧瓶;
(4)H2O2具有强氧化性,将二氧化硫氧化为硫酸,化学方程式为SO2+H2O2===H2SO4,故答案为:SO2+H2O2===H2SO4;
(5)过氧化氢在催化剂作用下容易分解,除去H2O2,可以在反应后的溶液中加入二氧化锰并振荡,故答案为:加入二氧化锰并振荡;
(6)根据反应方程式,有SO2~H2SO4~2NaOH,n(SO2)= ![]() n(NaOH)=
n(NaOH)= ![]() ×0.04000 mol/L×0.025L=0.0005mol,质量为0.0005mol×64g/mol=0.032g,因此1L溶液中含有二氧化硫的质量为0.032g×
×0.04000 mol/L×0.025L=0.0005mol,质量为0.0005mol×64g/mol=0.032g,因此1L溶液中含有二氧化硫的质量为0.032g×![]() =0.32g,该葡萄酒中SO2的含量为0.32g/L,测定过程中,盐酸会挥发,导致反应后溶液酸的物质的量偏多,滴定时消耗的氢氧化钠偏多,使得结果偏大,故答案为:0.32;盐酸的挥发造成的干扰。
=0.32g,该葡萄酒中SO2的含量为0.32g/L,测定过程中,盐酸会挥发,导致反应后溶液酸的物质的量偏多,滴定时消耗的氢氧化钠偏多,使得结果偏大,故答案为:0.32;盐酸的挥发造成的干扰。


科目:高中化学 来源: 题型:
【题目】对于玻璃器皿上黏有的一些水洗不掉的残留物,下列洗涤方法正确的是
①残留在试管内壁上的碘,用酒精洗涤
②试剂瓶中残留的苯酚用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④黏附在试管壁上的油脂,用热碱液洗涤
A. ①③④ B. ②③④ C. ①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3∶2∶1时,三种溶液中c(Cl-)之比为( )
A. l:2:3 B. 1:1:1 C. 3:2:l D. 3:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清溶液,其中可能含有Cu2+、Na+、Mg2+、Ba2+、Cl-、SO![]() 、CO
、CO![]() 离子。现进行以下实验:
离子。现进行以下实验:
①取适量该溶液加入足量氯化钡溶液,产生白色沉淀,过滤、洗涤后,向白色沉淀中加入足量稀硝酸沉淀部分溶解;
②取①过滤后的滤液少许于试管中,滴加硝酸银溶液,产生白色沉淀;
③ 取该溶液少许于试管中加入氢氧化钠溶液,无明显现象。
(1)根据上述事实确定:该溶液中肯定存在的离子有________;肯定不存在的离子有_____________;可能存在的离子有__________。
(2)写出①中沉淀部分溶解的反应的离子方程式______________________________。
(3)判断①中沉淀是否洗涤干净的方法:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活中有着广泛的应用。下列说法不正确的是
A. 明矾可用于水的杀菌消毒
B. 炒菜时加碘食盐最好最后放
C. 雾霾天气中可以产生丁达尔现象
D. 燃料的脱硫和脱氮都是减少酸雨产生的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X和Y能发生如下反应:X+Y=H2O+盐,下列有关物质X和Y所属种类的判断中一定不正确的是( )
A. X为酸、Y为碱 B. X为碱性氧化物、Y为酸
C. X为盐、Y为碱 D. X为碱性氧化物、Y为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,曾获得诺贝尔化学奖。钯(Pd)元素的原子序数为46,下列叙述错误的是( )
A. 10246Pd和10346Pd互为同位素
B. 钯是第五周期元素
C. Pd2+核外有48个电子
D. 10846Pd的原子核内有62个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知离子反应:RO3n -+ 6I- + 6H+ = R- + 3I2 + 3H2O,则R元素在RO3n-中的化合价是( )
A. +1 B. +2 C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为( )
A. 硫酸盐 B. 硫化物 C. 碳酸盐 D. 以上沉淀剂均可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com