
【题目】要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为( )
A. 硫酸盐 B. 硫化物 C. 碳酸盐 D. 以上沉淀剂均可
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
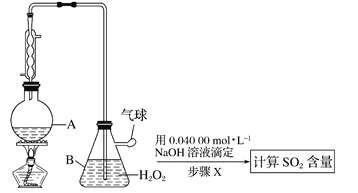
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而成的酸性有机饮料,其主要成分是苹果酸。某校化学兴趣小组对苹果醋提纯后得到苹果酸,其结构简式为 。
。
(1)苹果酸分子中所含官能团的名称是_______________、_______________。
(2)苹果酸分子式是_______________。
(3)1 mol苹果酸与足量金属钠反应,可产生_______ mol H2。
(4)1 mol苹果酸与足量NaHCO3溶液反应,可产生_______mol CO2。
(5)氧元素的质量分数为______________。
(6)苹果酸不可能发生的反应有________(填序号)。
①加成反应 ②酯化反应 ③加聚反应
④氧化反应 ⑤消去反应 ⑥取代反应
(7)一定条件下,2 mol苹果酸发生反应,生成1 mol含有八元环的化合物和2 mol H2O,写出反应的化学方程式__________________________________。
(8)该苹果酸有多种同分异构体,写出符合下列条件的同分异构体的结构简式_______________(填写其中一种)。
①在一定条件下,能够发生银镜反应;
②能够与苯甲酸发生酯化反应;
③能够与乙醇发生酯化反应;
④分子中同一碳原子上不存在两个—OH基;
⑤1 mol该酸与足量的金属钠反应产生1.5 mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是
A、体积比为1:1 B、体积比为11:16
C、物质的量比为16:11 D、密度比为11:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需克服相同类型作用力的是( )。
A. 碘和干冰的升华 B. Na2O2和C60的熔化
C. 氯化氢和氯化钾的溶解 D. 溴的气化和NH4Cl加热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.碳酸氢钠能与碱反应,可用作食品膨松剂
B.MgO的熔点很高,可用于制作耐高温材料
C.二氧化硫具有漂白性,可用其水溶液吸收溴蒸气
D.氯化铁溶液呈酸性,可用于蚀刻铜电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列客观事实与氢键无关的是( )
A. 冰的密度比水小 B. H2O的分解温度比H2S高得多
C. 液态氟化氢中有三聚氟化氢 D. NH3的沸点比PH3高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若质量相等,则质子数相等 B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积相等 D. 若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用固体NaOH来配制0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有____________(填代号),还缺少的玻璃仪器是___________________________________。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为______________。
(4)在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是______________。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中
C.容量瓶不干燥,含有少量蒸馏水
D.定容时俯视标线 E.称量时间过长
(5)用配制好的溶液,再来配制50mL 0.2mol/L的NaOH溶液,需要取原配好的溶液____mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com