
【题目】苹果醋是一种由苹果发酵而成的酸性有机饮料,其主要成分是苹果酸。某校化学兴趣小组对苹果醋提纯后得到苹果酸,其结构简式为 。
。
(1)苹果酸分子中所含官能团的名称是_______________、_______________。
(2)苹果酸分子式是_______________。
(3)1 mol苹果酸与足量金属钠反应,可产生_______ mol H2。
(4)1 mol苹果酸与足量NaHCO3溶液反应,可产生_______mol CO2。
(5)氧元素的质量分数为______________。
(6)苹果酸不可能发生的反应有________(填序号)。
①加成反应 ②酯化反应 ③加聚反应
④氧化反应 ⑤消去反应 ⑥取代反应
(7)一定条件下,2 mol苹果酸发生反应,生成1 mol含有八元环的化合物和2 mol H2O,写出反应的化学方程式__________________________________。
(8)该苹果酸有多种同分异构体,写出符合下列条件的同分异构体的结构简式_______________(填写其中一种)。
①在一定条件下,能够发生银镜反应;
②能够与苯甲酸发生酯化反应;
③能够与乙醇发生酯化反应;
④分子中同一碳原子上不存在两个—OH基;
⑤1 mol该酸与足量的金属钠反应产生1.5 mol H2。
【答案】 醇羟基 羧基 C4H6O5 1.5 2 59.7% ①③ 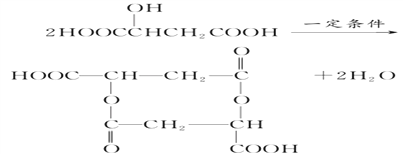
![]() 或
或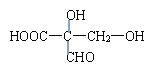
【解析】(1)根据苹果酸的结构简式可知分子中所含官能团的名称是羧基、羟基。(2) 根据苹果酸的结构简式可知苹果酸分子式是C4H6O5。(3)羧基和羟基均能与钠反应生成氢气,则1 mol苹果酸与足量金属钠反应,可产生1.5 mol H2。(4)羧基与碳酸氢钠反应,羟基不反应,1 mol苹果酸与足量NaHCO3溶液反应,可产生2mol CO2。(5)氧元素的质量分数为![]() 。(6)苹果酸分子中所含官能团的名称是羧基、羟基,可以发生酯化反应、缩聚反应、氧化反应、消去反应和取代反应,不可能发生的反应有加成反应和加聚反应,答案选①③。(7)一定条件下,2 mol苹果酸发生反应,生成1 mol含有八元环的化合物和2 mol H2O,反应的化学方程式为
。(6)苹果酸分子中所含官能团的名称是羧基、羟基,可以发生酯化反应、缩聚反应、氧化反应、消去反应和取代反应,不可能发生的反应有加成反应和加聚反应,答案选①③。(7)一定条件下,2 mol苹果酸发生反应,生成1 mol含有八元环的化合物和2 mol H2O,反应的化学方程式为 。(8)①在一定条件下,能够发生银镜反应,含有醛基;②能够与苯甲酸发生酯化反应,含有羟基;③能够与乙醇发生酯化反应,含有羧基;④分子中同一碳原子上不存在两个—OH基;⑤1 mol该酸与足量的金属钠反应产生1.5 mol H2,因此符合条件的有机物结构简式可以是
。(8)①在一定条件下,能够发生银镜反应,含有醛基;②能够与苯甲酸发生酯化反应,含有羟基;③能够与乙醇发生酯化反应,含有羧基;④分子中同一碳原子上不存在两个—OH基;⑤1 mol该酸与足量的金属钠反应产生1.5 mol H2,因此符合条件的有机物结构简式可以是![]() 或
或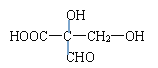 。
。


 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3∶2∶1时,三种溶液中c(Cl-)之比为( )
A. l:2:3 B. 1:1:1 C. 3:2:l D. 3:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,曾获得诺贝尔化学奖。钯(Pd)元素的原子序数为46,下列叙述错误的是( )
A. 10246Pd和10346Pd互为同位素
B. 钯是第五周期元素
C. Pd2+核外有48个电子
D. 10846Pd的原子核内有62个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知离子反应:RO3n -+ 6I- + 6H+ = R- + 3I2 + 3H2O,则R元素在RO3n-中的化合价是( )
A. +1 B. +2 C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请计算并填空:
(1)含有相同氧原子数的CO和CO2 ,其分子数之比为__________________。
(2))在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,该金属原子的摩尔质量为___________。
(3)48g CH4与标准状况下 ____________L NH3所含H原子个数相等。
(4)在0.4L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,该混合溶液中,含溶质MgCl2的质量为________g;将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分离和提纯在生产和研究中都有重要的应用,请回答:
(1)填写仪器名称:A_______________、B_______________、C_______________。
(2)装置④可以进行________(填操作名称),其中明显的两处错误是:_______________________;_______________________。

(3)下列做法正确的是__________(填字母)。
A.分离花生油和水应选装置④
B.粗盐提纯时可选装置①和②
C.用CCl4提取碘水中的碘应选装置③
D.盛装NaOH溶液的装置⑤可吸收O2中混有的CO2,且气体应a进b出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。

根据上述实验,以下推测不正确的是
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为( )
A. 硫酸盐 B. 硫化物 C. 碳酸盐 D. 以上沉淀剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.099 | 0.186 | 0.074 | 0.143 | ||
主要化合价 | +4,-4 | -2 | -1,+7 | +3 | ||
其他 | 常温下为黄色固体 | 无机非金属材料的主角 | 颜色反应为黄色 | 其氧化物可做耐火材料 |
(1)Q在元素周期表中的位置是______.
(2)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是______(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是______.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______.
(5)已知1mo1XM2(g)被氧化为1mo1XM3(g)的△H=﹣99kJ/mo1.写出由XM2生成XM3的热化学反应方程式 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com