
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.099 | 0.186 | 0.074 | 0.143 | ||
主要化合价 | +4,-4 | -2 | -1,+7 | +3 | ||
其他 | 常温下为黄色固体 | 无机非金属材料的主角 | 颜色反应为黄色 | 其氧化物可做耐火材料 |
(1)Q在元素周期表中的位置是______.
(2)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是______(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是______.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______.
(5)已知1mo1XM2(g)被氧化为1mo1XM3(g)的△H=﹣99kJ/mo1.写出由XM2生成XM3的热化学反应方程式 ________。
【答案】 第三周期第ⅢA族 Cl bc 0.099~0.143nm Na2SiO3 SO2(g)+O2(g)SO3(g) ; H=-99 kJ/mol
【解析】X、Y、Z、M、R、Q是短周期主族元素,常温下X单质为黄色固体,则X为S元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;M的主要化合价为-2价,为第ⅥA族元素,原子半径M<Cl,则M为O元素;
(1)R为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子数为7,位于周期表第三周期第ⅦA族;
(2)Y为Si,R为Cl,位于同一周期,根据同周期元素非金属性从左到右逐渐增强可知,Cl的非金属性大于Si;a.属于物质的物理性质,不能比较非金属性的强弱,故a错误;b.Y与R形成的化合物中Y呈正价,说明R得电子能力强,非金属性强,故b正确;c.元素的非金属性越强,对应的氢化物越稳定,故c正确;故答案为bc;
(3)Y为Si,与Al、Cl位于相同周期,同周期元素从左到右原子半径逐渐减小,则Si的原子半径比Al小,比Cl大,即大于0.099nm小于0.143nm;
(4)甲+乙→丙+水,应为中和反应,若丙的水溶液呈碱性,则对应的物质的应为强碱弱酸盐,可为NaAlO2或Na2SiO3;
(5)单质硫的燃烧热为296kJmol-1,则热化学方程式为:S(s)+O2=SO2(g)△H=-296kJ/mol,1mo1SO2(g)被氧化为1mo1SO3(g)的△H=-99kJ/mo1,则热化学方程式为:2SO2(g)+O2=2SO3(g)△H=-198kJ/mol,根据盖斯定律,可知S(s)生成3mo1SO3(g)的△H=(-296kJ/mol)×3+![]() ×(-198kJ/mo1)=-1185kJ/mol。
×(-198kJ/mo1)=-1185kJ/mol。


科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而成的酸性有机饮料,其主要成分是苹果酸。某校化学兴趣小组对苹果醋提纯后得到苹果酸,其结构简式为 。
。
(1)苹果酸分子中所含官能团的名称是_______________、_______________。
(2)苹果酸分子式是_______________。
(3)1 mol苹果酸与足量金属钠反应,可产生_______ mol H2。
(4)1 mol苹果酸与足量NaHCO3溶液反应,可产生_______mol CO2。
(5)氧元素的质量分数为______________。
(6)苹果酸不可能发生的反应有________(填序号)。
①加成反应 ②酯化反应 ③加聚反应
④氧化反应 ⑤消去反应 ⑥取代反应
(7)一定条件下,2 mol苹果酸发生反应,生成1 mol含有八元环的化合物和2 mol H2O,写出反应的化学方程式__________________________________。
(8)该苹果酸有多种同分异构体,写出符合下列条件的同分异构体的结构简式_______________(填写其中一种)。
①在一定条件下,能够发生银镜反应;
②能够与苯甲酸发生酯化反应;
③能够与乙醇发生酯化反应;
④分子中同一碳原子上不存在两个—OH基;
⑤1 mol该酸与足量的金属钠反应产生1.5 mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列客观事实与氢键无关的是( )
A. 冰的密度比水小 B. H2O的分解温度比H2S高得多
C. 液态氟化氢中有三聚氟化氢 D. NH3的沸点比PH3高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若质量相等,则质子数相等 B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积相等 D. 若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法正确的是
A. 燃烧属于放热反应 B. 中和反应是吸热反应
C. 形成化学键时吸收能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g) ![]() 2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A.保持温度和容器体积不变,充入1mol SO2(g)
B.保持温度和容器内压强不变,充入1mol SO3(g)
C.保持温度和容器内压强不变,充入1mol O2(g)
D.保持温度和容器内压强不变,充入1mol Ar(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化中,一定要加入合适的氧化剂才能实现的是( )
A. Na2O2→O2 B. Cl2→Cl- C. Fe(OH)2→Fe(OH)3 D. NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用固体NaOH来配制0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有____________(填代号),还缺少的玻璃仪器是___________________________________。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为______________。
(4)在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是______________。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中
C.容量瓶不干燥,含有少量蒸馏水
D.定容时俯视标线 E.称量时间过长
(5)用配制好的溶液,再来配制50mL 0.2mol/L的NaOH溶液,需要取原配好的溶液____mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
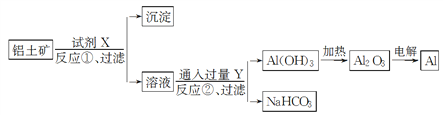
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com