
| A、溶液中析出0.05mol Cu |
| B、溶液中析出0.1mol Ag |
| C、溶液中Cu2+与Fe2+的浓度之比为1:2 |
| D、往反应后的溶液中再加入0.1mol 铁粉,铁粉恰好完全溶解 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、铝制器皿不宜盛放酸性食物 |
| B、电解食盐水时阴极产生氢气 |
| C、可用铁制容器盛放和运输浓硫酸 |
| D、镀锌铁桶镀层破损后铁仍不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
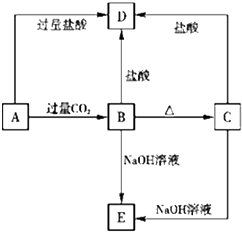 A、B、C、D、E五种化合物,均含有前18号元素中某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).
A、B、C、D、E五种化合物,均含有前18号元素中某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).查看答案和解析>>
科目:高中化学 来源: 题型:
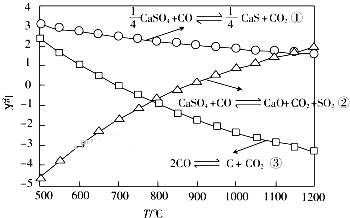 一氧化碳在高温下可还原硫酸钙,相关反应的平衡常数的对数与反应温度的关系如图所示.
一氧化碳在高温下可还原硫酸钙,相关反应的平衡常数的对数与反应温度的关系如图所示.| 1 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中有Fe2+、Cu2+ |
| B、剩下的固体是Fe和Cu |
| C、溶液中有Fe3+、Fe2+ |
| D、剩下的固体是Fe,无Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当溶液中Al3+全部沉淀出来时,沉淀的总物质的量最大 |
| B、当溶液中Al3+全部沉淀出来时,沉淀的总质量最大 |
| C、先生成沉淀,后沉淀全部溶解 |
| D、最后的沉淀为2mol BaSO4、1mol Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,2克氢气所含原子数目为NA |
| B、4.6克钠与水反应时失去的电子数目为0.2NA |
| C、在标准状况下,22.4LNH3所含的质子数目为NA |
| D、1 L0.5mol?L-1Na2SO4溶液中所含有的Na+离子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com