
| △c |
| △t |
| [CO 2]?[H 2] |
| [CO]?[H 2O] |
| [CO 2]?[H 2] |
| [CO]?[H 2O] |
| x×x |
| (0.1-x)×(0.1-x) |
| ||
| 10min |


科目:高中化学 来源: 题型:
| A、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| B、铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C、锌作阳极,镀件作阴极,溶液中含有锌离子 |
| D、锌用阴极,镀件作阳极,溶液中含有锌离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
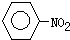
| Fe、HCl、H2O |
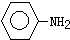 (苯胺,弱碱性、易氧化)
(苯胺,弱碱性、易氧化)
| KMnO4、H+ |
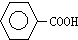
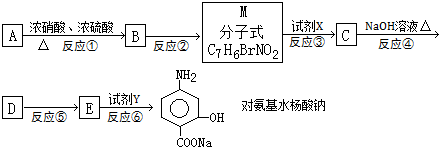
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用含氢氧化铝的药剂治疗胃酸过多 |
| B、用苏打中和发酵面团中的酸 |
| C、用醋酸清洗热水瓶内壁附着的水垢 |
| D、用二氧化硫熏蒸银耳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中析出0.05mol Cu |
| B、溶液中析出0.1mol Ag |
| C、溶液中Cu2+与Fe2+的浓度之比为1:2 |
| D、往反应后的溶液中再加入0.1mol 铁粉,铁粉恰好完全溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、②⑤ | D、④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C原子的四个杂化轨道的能量一样 |
| B、C原子的sp3杂化轨道之间夹角一样 |
| C、C原子有1个sp3杂化轨道由孤电子对占据 |
| D、C原子的4个价电子分别占据4个sp3杂化轨道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com