
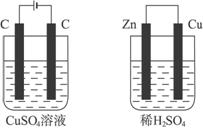
如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,则下列叙述中正确的是( )
A.产生气体的体积:①>②
B.溶液的pH变化:①不变 ②增大
C.①和②中铜电极均失电子
D.电极反应式:①中阳极 ![]() ②中负极
②中负极 ![]()
科目:高中化学 来源: 题型:
① ②
A.产生气体的体积:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式①中阳极:4OH--4e![]() 2H2O+O2↑ ②中负极:2H++2e-
2H2O+O2↑ ②中负极:2H++2e-![]() H2↑
H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:

A.产生气体的体积:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①中阳极:4OH--4e-====2H2O+O2↑;②中负极:2H++2e-====H2↑
查看答案和解析>>
科目:高中化学 来源:2014届浙江东阳中学、兰溪一中高一下学期期中考试化学卷(解析版) 题型:选择题
如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,则下列叙述中正确的是( )

A.产生气体的体积:①>②
B.溶液的pH变化:①不变 ②增大
C.①和②中铜电极均失电子
D.电极反应式:①中阳极  ②中负极
②中负极 
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
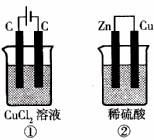
A. 产生气体的体积:①>②
B. 溶液的pH变化:①增大,②不变
C. 电极上析出物质的质量:①>②
D. 电极反应式:①中阳极 ![]() ②中负极
②中负极![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com