
 图为一个原电池,完成下列问题:
图为一个原电池,完成下列问题:分析 (1)该原电池中,Zn易失电子作负极、Cu作正极,电解质溶液是稀硫酸;
(2)负极上锌失电子发生氧化反应生成锌离子,正极上氢离子得电子发生还原反应生成氢气.
解答 解:(1)该原电池中,Zn的活动性大于Cu,所以Zn易失电子作负极、Cu作正极,电解质溶液是稀硫酸,
故答案为:锌片;铜片;稀H2SO4;
(2)负极上锌失电子发生氧化反应生成锌离子,负极反应式为Zn-2e?=Zn2+;正极上氢离子得电子发生还原反应生成氢气,正极反应式为2H++2e?=H2↑,
故答案为:Zn-2e?=Zn2+;2H++2e?=H2↑.
点评 本题考查原电池原理,为高频考点,根据失电子难易程度判断正负极,知道各个电极上发生的反应,会正确书写电极反应式,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
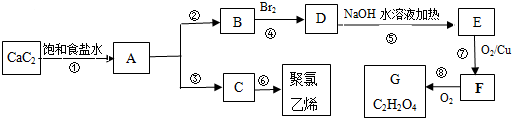
 非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.
非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

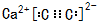 ,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2
,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2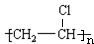 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按照有机物系统命名法,化合物 的名称为:3,3-二乙基戊烷 的名称为:3,3-二乙基戊烷 | |
| B. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次递增 | |
| C. | 甘氨酸H2N-CH2COOH、丙氨酸CH3CH(NH2)COOH、谷氨酸HOOCCH2CH2CH(NH2)COOH一定条件下形成链状三肽的结构最多有33种 | |
| D. | 分子式为C5H10O2的所有酯类的同分异构体共有9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )
把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )| A. | ①④ | B. | ①②③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,Y和Z的生成速率之比为3:4 | |
| B. | c1的取值范围为0<c1<0.28 mol•L-1 | |
| C. | 当反应达到平衡时,扩大容器的体积,平衡会发生移动 | |
| D. | 此反应,若起始通入2 mol•L-1的X和3 mol•L-1的Y达到平衡时,与起始只通入4 mol•L-1的Z达到平衡时,各物质的组成含量不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com