
| ||
| ||


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:

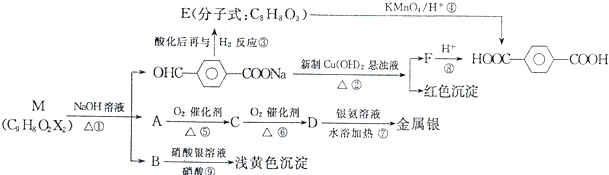
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | ||
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E(C4H8O2)是具有果香气味的液体.A、B、C、D在一定条件下有如下转化关系(部分反应条件、产物被省略)
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E(C4H8O2)是具有果香气味的液体.A、B、C、D在一定条件下有如下转化关系(部分反应条件、产物被省略)| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com