


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
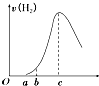 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图所示的坐标曲线来表示:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图所示的坐标曲线来表示:| A、O→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
| B、b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
| C、c点时反应处平衡状态 |
| D、t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
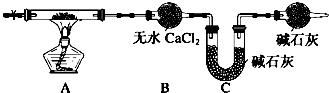
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系中气体的密度发生变化,说明反应没有达到平衡状态 |
| B、体系中各组分的体积分数发生变化,说明平衡发生了移动 |
| C、△S>0的反应一定是自发反应 |
| D、反应达到平衡状态时,正、逆反应速率均为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
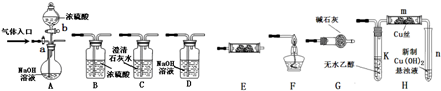
查看答案和解析>>
科目:高中化学 来源: 题型:
 测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数.现有下列实验用品:800mL烧杯、100mL量筒、短颈漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g/L)、水.按图示装置进行实验,回答下列问题.(设合金样品完全反应,产生的气体体积不超过100mL)
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数.现有下列实验用品:800mL烧杯、100mL量筒、短颈漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g/L)、水.按图示装置进行实验,回答下列问题.(设合金样品完全反应,产生的气体体积不超过100mL)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com