
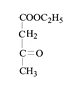
【题目】高分子化合物M的合成路线如下:
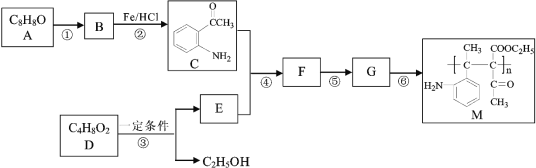
已知: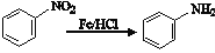
(1)A中含氧官能团的名称是______。
(2)反应①的试剂和条件为_______,B的结构简式为_________。
(3)写出反应的①化学方程式__________。
(4)写出反应的⑥化学方程式________。
(5)D为酯类,2D → E + C2H5OH,F中含有醇羟基,写出下列物质的结构简式: E______ 、F_______。
(6)反应①~⑥中属于取代反应的有_______。
【答案】羰基 浓硝酸/浓硫酸、加热 
 +HNO3
+HNO3 ![]()
 +H2O
+H2O 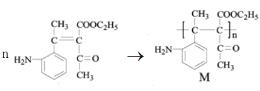
 ①③
①③
【解析】
根据C的结构简式和反应条件Fe/HCl可知,B到C是硝基还原成氨基,推出B的结构简式 ,根据B可知A在浓硝酸和浓硫酸,加热条件下发生取代反应生成B(
,根据B可知A在浓硝酸和浓硫酸,加热条件下发生取代反应生成B( ),由此推测出A
),由此推测出A ;根据产物M(
;根据产物M(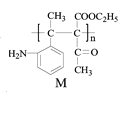 )逆推,可知单体G为
)逆推,可知单体G为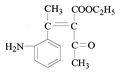 ,因为F中含有醇羟基,可知是F发生醇消去反应生成G,再联系C(
,因为F中含有醇羟基,可知是F发生醇消去反应生成G,再联系C(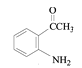 )的结构,可知F为
)的结构,可知F为 ,根据F(
,根据F( )和C(
)和C( )逆推出E(
)逆推出E( ),因为2D → E + C2H5OH,可知两分子D发生取代反应:2CH3COOC2H5 →
),因为2D → E + C2H5OH,可知两分子D发生取代反应:2CH3COOC2H5 →  + C2H5OH,可知D为CH3COOC2H5。
+ C2H5OH,可知D为CH3COOC2H5。
(1)由以上分析可知A的结构简式为 ,A中含氧官能团的名称是羰基;
,A中含氧官能团的名称是羰基;
(2)反应①为 +HNO3
+HNO3 ![]()
 +H2O,因此试剂和条件为浓硝酸/浓硫酸、加热,的结构简式为
+H2O,因此试剂和条件为浓硝酸/浓硫酸、加热,的结构简式为 ;
;
(3)反应①为 +HNO3
+HNO3 ![]()
 +H2O;
+H2O;
(4)根据产物M( )逆推,可知单体G为
)逆推,可知单体G为 ,反应⑥为:n
,反应⑥为:n
![]()
 ;
;
(5)由上面分析可知:2CH3COOC2H5 →  + C2H5OH,E为
+ C2H5OH,E为 ,F为
,F为 ;
;
(6)反应①为硝化反应,属于取代反应,反应②为硝基还原为氨基,属于还原反应,反应③为乙酸乙酯发生分子间取代反应,④属于加成反应⑤属于消去反应⑥属于加聚反应,因此反应①~⑥中属于取代反应的有①③。


科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
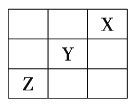
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。
实验一:通过质谱分析仪分析得知有机物A的相对分子质量为90。
实验二:用红外光谱分析发现有机物A中含有—COOH和 —OH。
实验三:取1.8g有机物A完全燃烧后,测得生成物为2.64gCO2和1.08gH2O。
实验四:经核磁共振检测发现有机物A的谱图中H原子峰值比为3:1:1:1。
(1)有机物A的结构简式为_______。
(2)有机物A在一定条件下可以发生的反应有_______。
a.消去反应 b.取代反应 c.聚合反应 d.加成反应 e.氧化反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B的分子式为C3H4O2,B能和溴发生加成反应,则B的结构简式为_______。另一种产物C是一种六元环状酯,写出生成C的化学方程式:_______。
(4)写出A与足量的金属钠反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
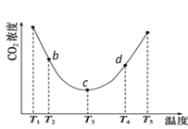
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应: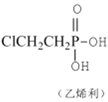 +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
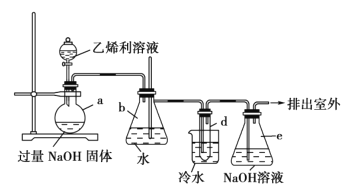
(1)仪器b的名称为______;其中长玻璃导管的作用是______。
(2)e装置的作用是______;其中所发生反应的离子方程式为______。
(3)试管d中发生反应的化学方程式为______。若用冰水代替烧杯中的冷水,可能引起的不安全后果是______。
(4)实验消耗40%乙烯利(摩尔质量为Mg·mol-1)溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为______(用含M、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( )
选项 | A | B | C | D |
实验步骤 | 制备NH3 | 制备NaHCO3 | 分离NaHCO3 | 煅烧NaHCO3 |
实验装置 |
|
|
|
|
解释或说明 | 试剂X可选择NH4Cl | 从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率 | 该装置可用于分 离NaHCO3 | 无水CuSO4的作用是检验NaHCO3是否完全分解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作所得出的现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成红色 | 原溶液中含有Fe2+ |
B | 将变黑的银器放入装满食盐水的铝盆中,二者直接接触 | 银器恢复往日光泽 | 2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+3H2S↑ |
C | 向铬酸钾溶液中加入硫酸[已知:Cr2O72- (橙色)+H2O | 溶液由橙色变为黄色 | Cr2O72-转变为CrO42- |
D | 将石蜡油气化后,使气体流经碎瓷片,将生成的气体通入酸性高锰酸钾溶液 | 溶液紫红色褪去 | 碎瓷片的主要作用是使石蜡油受热均匀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A、υ(A)=0.5mol/(L·min) B、υ(B)=1.2mol/(L·s)
C、υ(C)=0.1mol/(L·s) D、υ(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
(1)硫酸铜溶液可以加快氢气生成速率的原因是____。
(2)25℃,该同学设计三个实验探究影响锌粉(足量)与稀硫酸反应速率的因素,有关数据如下表所示:
实验序号 | 体积/mL | ||
1.0mol·L-1硫酸溶液 | 饱和CuSO4溶液 | 水 | |
I | 30.0 | 1.0 | 9.0 |
II | 20.0 | 1.0 | Vx |
III | 30.0 | 3.0 | 7.0 |
①本实验待测数据可以是____。
②利用实验I和实验I来探究硫酸浓度对锌粉与稀硫酸反应速率的影响,Vx=__,理由是__。
③实验I和实验III的目的是__。
(3)用排水集气法收集实验I反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 60 | 140 | 252 | 420 | 510 | 540 |
①反应速率最大时间段是__min(填“0~1”、“1~2”、“2~3”、“3~4”、“4~5”或“5~6”下同),原因是____。
②反应速率最小时段是__min,原因是___。
③第2~3min时间段以稀硫酸的浓度表示的该反应速率(设溶液体积不变)是v(H2SO4)=___。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在稀硫酸中分别加入等体积的下列溶液,可行的是____(填字母)。
A.KNO3溶液 B.蒸馏水 C.Na2SO4溶液 D.Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com